Comment le point d'ébullition de l'eau change-t-il en fonction de la pression? Début d'ébullition
Conditions de la substance Fer à vapeur et air solide
N'est-ce pas une étrange combinaison de mots? Cependant, cela n’est pas insensé: la vapeur de fer et l’air solide existent dans la nature, mais pas dans des conditions ordinaires.
De quelles conditions parle-t-on? L'état d'une substance est déterminé par deux circonstances: la température et la pression.
Notre vie continue dans des conditions relativement peu changeantes. La pression atmosphérique fluctue de quelques pour cent autour d'une atmosphère; la température de l’air dans la région de Moscou, par exemple, est comprise entre -30 et + 30 ° C; dans l'échelle de température absolue, dans laquelle la température la plus basse possible (-273 ° С) est prise égale à zéro; cet intervalle paraîtra moins impressionnant: 240-300 K, ce qui ne représente également que ± 10% de la valeur moyenne.
Il est tout à fait naturel que nous soyons habitués à ces conditions habituelles et que, par conséquent, énonçant des vérités simples comme: «le fer est un corps solide, l'air est un gaz», etc., nous oublions d'ajouter: «dans des conditions normales».
Si vous chauffez le fer, il va d'abord fondre, puis s'évaporer. Si l'air est refroidi, il se transformera d'abord en liquide, puis se durcira.
Même si le lecteur n’a jamais rencontré de vapeur de fer ni d’air solide, il croira probablement que toute substance peut être obtenue en modifiant la température à la fois en état solide et liquide et en état gazeux, ou, comme on dit, en état solide. phases liquides ou gazeuses.
Il est facile d'y croire car une substance, sans laquelle la vie sur Terre serait impossible, a été observée par tout le monde sous forme de gaz, de liquide et de solide. Bien sûr, il s'agit d'eau.
Dans quelles conditions les substances se transforment-elles d'un état à un autre?
Ébullition
Si vous abaissez le thermomètre dans l'eau qui est versée dans la bouilloire, allumez le poêle et surveillez le mercure du thermomètre, nous verrons ce qui suit: presque immédiatement, le niveau de mercure augmente. Pour 90, 95, enfin 100 ° C. L'eau bout et en même temps la montée du mercure s'arrête. L'eau bout depuis plusieurs minutes mais le niveau de mercure ne change pas. Jusqu'à ce que toute l'eau bout, la température ne changera pas (Fig. 4.1).
Fig. 4.1
Où va la chaleur si la température de l'eau ne change pas? La réponse est évidente. Le processus de transformation de l'eau en vapeur nécessite de l'énergie.
Comparons l'énergie d'un gramme d'eau et d'un gramme de vapeur formée à partir de celle-ci. Les molécules de vapeur sont situées plus loin les unes des autres que les molécules d'eau. Il est clair qu’à cause de cela, l’énergie potentielle de l’eau sera différente de celle de la vapeur.
L'énergie potentielle d'attirer des particules diminue avec leur approche. Par conséquent, l’énergie de la vapeur est supérieure à celle de l’eau et la conversion de l’eau en vapeur nécessite de l’énergie. Cette énergie excédentaire est communiquée par la cuisinière électrique qui fait bouillir l’eau dans la bouilloire.
Énergie - nécessaire pour transformer l’eau en vapeur; appelé la chaleur de vaporisation. Pour convertir 1 g d'eau en vapeur, il faut 539 cal (il s'agit d'une valeur pour une température de 100 ° C).
Si 539 cal sont consommés pour 1 g, alors 18 * 539 \u003d 9700 cal seront consommés pour 1 mole d’eau. Une telle quantité de chaleur doit être dépensée pour rompre les liaisons intermoléculaires.
Vous pouvez comparer ce chiffre à la quantité de travail nécessaire pour rompre les liens intramoléculaires. Pour fractionner 1 mole de vapeur d’eau en atomes, il faut environ 220 000 calories, soit 25 fois plus d’énergie. Cela prouve directement la faiblesse des forces qui lient les molécules les unes aux autres, par rapport aux forces qui entraînent les atomes dans une molécule.
Dépendance du point d'ébullition à la pression
Le point d'ébullition de l'eau est de 100 ° C; on pourrait penser que c'est une propriété intégrale de l'eau, que l'eau, où et quelles que soient les conditions, bouillira toujours à 100 ° C.
Mais ce n’est pas le cas et les habitants des villages de haute montagne le savent bien.
Près du sommet d'Elbrus, il y a une maison pour les touristes et une station de recherche. Les débutants sont parfois surpris par "la difficulté de faire bouillir un œuf dans de l'eau bouillante" ou par "pourquoi il ne brûle pas l'eau bouillante". Dans ces conditions, on leur dit que l'eau bout au-dessus d'Elbrus déjà à 82 ° C.
Quel est le problème ici? Quel facteur physique interfère avec le phénomène d'ébullition? Que signifie altitude?
Ce facteur physique est la pression agissant sur la surface du liquide. Pas besoin de grimper au sommet de la montagne pour vérifier la véracité de ce qui a été dit.
En plaçant de l'eau chauffée sous la cloche et en pompant ou en extrayant de l'air à partir de là, vous pouvez vous assurer que le point d'ébullition augmente avec l'augmentation de la pression et diminue avec la diminution de la pression.
L'eau bout à 100 ° C seulement à une certaine pression - 760 mm Hg. Art. (ou 1 atm).
La courbe de la température d'ébullition en fonction de la pression est illustrée à la Fig. 4.2. Au sommet d'Elbrus, la pression est de 0,5 atm et cette pression correspond à un point d'ébullition de 82 ° C.

Fig. 4.2
Mais avec de l'eau bouillante à 10-15 mm Hg. Art., Vous pouvez vous rafraîchir par temps chaud. À cette pression, le point d'ébullition tombe à 10-15 ° C.
Vous pouvez même obtenir de "l'eau bouillante" à la température de l'eau glacée. Pour ce faire, vous devrez réduire la pression à 4,6 mm RT. Art.
Une image intéressante peut être observée si vous placez un récipient ouvert avec de l’eau sous la cloche et pompez l’air. Le pompage fera bouillir l'eau, mais l'ébullition nécessite de la chaleur. Il n’ya nulle part où le prendre et l’eau devra céder son énergie. La température de l'eau bouillante commencera à baisser, mais à mesure que le pompage se poursuivra, la pression chutera également. Par conséquent, l'ébullition ne s'arrêtera pas, l'eau continuera à refroidir et finira par geler.
Une telle ébullition d'eau froide ne se produit pas uniquement lors du pompage d'air. Par exemple, lorsque l'hélice tourne, la pression dans la couche d'eau qui se déplace rapidement près de la surface métallique diminue de manière significative et l'eau bout dans cette couche, c'est-à-dire que de nombreuses bulles remplies de vapeur y apparaissent. Ce phénomène s'appelle la cavitation (du mot latin cavitas - cavité).
En abaissant la pression, on abaisse le point d'ébullition. Et l'augmenter? Un horaire comme le nôtre répond à cette question. Une pression de 15 atm peut retarder l'ébullition de l'eau, elle ne commencera qu'à 200 ° C et une pression de 80 atm ne fera bouillir l'eau qu'à 300 ° C.
Ainsi, un certain point d’ébullition correspond à une certaine pression externe. Mais cette déclaration peut aussi être «chamboulée» en disant ceci: chaque point d’ébullition d’eau a sa propre pression spécifique. Cette pression s'appelle pression de vapeur.
La courbe décrivant le point d'ébullition en fonction de la pression est également la courbe de pression de vapeur en fonction de la température.
Les chiffres portés sur le graphique du point d'ébullition (ou sur le graphique de la pression de vapeur) montrent que la pression de vapeur varie très fortement avec la température. À 0 ° C (273 K), la pression de vapeur est de 4,6 mm de mercure. Art., À 100 ° C (373 K), il est égal à 760 mm RT. L’art., C’est-à-dire, augmente de 165 fois. Lorsque la température est doublée (de 0 ° C, soit 273 K à 273 ° C, soit 546 K), l’élasticité de la vapeur augmente à partir de 4,6 mm Hg. Art. jusqu’à près de 60 atm, soit environ 10 000 fois.
Par conséquent, au contraire, le point d'ébullition change avec la pression plutôt lentement. Avec un double changement de pression de 0,5 atm à 1 atm, le point d'ébullition augmente de 82 ° C (355 K) à 100 ° C (373 K) et avec un double changement de 1 à 2 atm, de 100 ° C (373 K) à 120 ° C (393 K).
La même courbe que nous examinons maintenant contrôle également la condensation (condensation) de la vapeur dans l’eau.
La vapeur peut être transformée en eau par compression ou par refroidissement.
Tant au point d’ébullition qu’en cours de condensation, la pointe ne quitte pas la courbe tant que la conversion de la vapeur en eau ou de l’eau en vapeur n’est pas complètement terminée. Ceci peut également être formulé comme suit: dans les conditions de notre courbe et uniquement dans ces conditions, la coexistence de liquide et de vapeur est possible. Si, en même temps, la chaleur n'est pas fournie ni évacuée, les quantités de vapeur et de liquide dans le récipient fermé resteront inchangées. Ils disent à propos de ces paires et de ce liquide qu’ils sont en équilibre, et la vapeur en équilibre avec son liquide est appelée saturée.
Comme nous le voyons, la courbe d’ébullition et de condensation a encore une signification: c’est une courbe d’équilibre liquide / vapeur. La courbe d'équilibre divise le champ de graphique en deux parties. À gauche et vers le haut (températures plus élevées et pressions plus basses) se trouve la région de l'état d'équilibre de la vapeur. À droite et en bas se trouve la région d’état d’équilibre du liquide.
La courbe d'équilibre vapeur-liquide, c'est-à-dire la courbe de dépendance du point d'ébullition à la pression ou, qui est la même, de la pression de vapeur à la température, est approximativement la même pour tous les liquides. Dans certains cas, le changement peut être un peu plus net, dans d'autres il peut être un peu plus lent, mais la pression de vapeur augmente toujours rapidement avec l'augmentation de la température.
Nous avons souvent utilisé les mots "gaz" et "vapeur". Ces deux mots sont assez égaux. Nous pouvons dire: le gaz d’eau est la vapeur d’eau, le gaz d’oxygène est la vapeur d’oxygène. Néanmoins, en utilisant ces deux mots, une certaine habitude s'est développée. Etant donné que nous sommes habitués à une certaine plage de températures relativement petite, le mot "gaz" s’applique généralement aux substances dont l’élasticité de la vapeur à la température ordinaire est supérieure à la pression atmosphérique. Au contraire, on parle de vapeur quand, à la température ambiante et à la pression atmosphérique, une substance est plus stable sous forme de liquide.
Évaporation
L'ébullition est un processus rapide et il n'y a aucune trace d'eau bouillante en peu de temps, elle se transforme en vapeur.
Mais il y a un autre phénomène de conversion de l'eau ou d'un autre liquide en vapeur d'eau: il s'agit de l'évaporation. L'évaporation se produit à n'importe quelle température, quelle que soit la pression, qui, dans des conditions normales, est toujours proche de 760 mm Hg. Art. L'évaporation, contrairement à l'ébullition, est un processus très lent. Une bouteille d'eau de Cologne que nous avons oublié de fermer sera vide au bout de quelques jours; plus de temps o tenir la soucoupe avec de l'eau, mais tôt ou tard elle sera sèche.
Dans le processus d'évaporation, l'air joue un rôle important. En soi, cela n'empêche pas l'eau de s'évaporer. Dès que nous ouvrons la surface du liquide, les molécules d'eau commenceront à se déplacer dans la couche d'air la plus proche.
La densité de vapeur dans cette couche augmentera rapidement; après un court laps de temps, la pression de vapeur deviendra égale à l'élasticité caractéristique de la température du fluide. Dans ce cas, la pression de vapeur sera exactement la même qu'en l'absence d'air.
Le passage de la vapeur à l'air ne signifie évidemment pas une augmentation de la pression. La pression totale dans l'espace situé au-dessus de la surface de l'eau n'augmente pas; seule la proportion de cette vapeur de vapeur augmente et, par conséquent, la proportion d'air déplacé par la vapeur diminue.
Au-dessus de l'eau, il y a de la vapeur mélangée à de l'air, au-dessus de laquelle se trouvent des couches d'air sans vapeur. Ils vont inévitablement se mélanger. La vapeur d'eau passera continuellement dans les couches supérieures et à sa place dans la couche inférieure viendra de l'air qui ne contient pas de molécules d'eau. Par conséquent, dans la couche la plus proche de l'eau, il y aura toujours de la place pour de nouvelles molécules d'eau. L'eau s'évaporera continuellement, en maintenant la pression de vapeur d'eau à la surface égale à l'élasticité, et le processus se poursuivra jusqu'à l'évaporation complète de l'eau.
Nous avons commencé par l'exemple de l'eau de cologne et de l'eau de Cologne. On sait qu'ils s'évaporent à des vitesses différentes. L'éther s'échappe très rapidement, l'alcool assez rapidement et l'eau beaucoup plus lentement. Nous comprendrons immédiatement quel est le problème ici si nous trouvons dans le manuel les valeurs de la pression de vapeur de ces liquides, par exemple à la température ambiante. Ces chiffres sont les suivants: éther - 437 mm Hg. Art., Alcool - 44,5 mm RT. Art. et eau - 17,5 mm RT. Art.
Plus l'élasticité est grande, plus il y a de vapeur dans la couche d'air adjacente et plus le liquide s'évapore rapidement. Nous savons que la pression de vapeur augmente avec la température. Il est clair que le taux d'évaporation augmente avec le chauffage.
Le taux d'évaporation peut également être affecté d'une autre manière. Si nous voulons aider à l'évaporation, nous devons éliminer rapidement les vapeurs du liquide, c'est-à-dire accélérer le mélange de l'air. C'est pourquoi l'évaporation est grandement accélérée par le soufflage de liquide. L’eau, bien qu’elle ait une pression de vapeur relativement faible, disparaîtra assez rapidement si elle est placée au vent.
On comprend donc pourquoi un nageur sortant de l’eau a froid au vent. Le vent accélère le mélange de l'air avec la vapeur et, par conséquent, accélère l'évaporation et la chaleur nécessaire à l'évaporation est forcée d'abandonner le corps humain.
Le bien-être d'une personne dépend de la présence ou non de vapeur d'eau dans l'air. L'air sec et humide sont désagréables. L'humidité est considérée comme normale lorsqu'elle atteint 60%. Cela signifie que la densité de vapeur d'eau correspond à 60% de la densité de vapeur d'eau saturée à la même température.
Si l'air humide est refroidi, la pression de la vapeur d'eau à la fin sera égale à la pression de vapeur à cette température. La vapeur va devenir saturée et lors de l'abaissement de la température va commencer à se condenser en eau. La rosée du matin, qui hydrate les herbes et les feuilles, apparaît en raison de ce phénomène.
À 20 ° C, la densité de vapeur d'eau saturée est d'environ 0,00002 g / cm 3. Nous nous sentirons bien s'il y a de la vapeur d'eau dans l'air à 60% de ce nombre - cela signifie seulement un peu plus d'un cent millième de gramme de 1 cm 3.
Bien que ce chiffre soit petit, il produira pour la pièce des quantités impressionnantes de vapeur. Il est facile de calculer que dans une pièce de taille moyenne d’une superficie de 12 m 2 et d’une hauteur de 3 m, elle peut «se loger» sous forme de vapeur saturée d’environ un kilogramme d’eau.
Donc, si vous fermez hermétiquement une telle pièce et mettez un baril d'eau ouvert, alors un litre d'eau s'évaporera, quelle que soit la capacité du baril.
Il est intéressant de comparer ce résultat pour l'eau avec les chiffres correspondants pour le mercure. À la même température de 20 ° C, la densité de vapeur de mercure saturée est de 10 -8 g / cm 3.
Dans la pièce que nous venons de mentionner, pas plus de 1 g de vapeur de mercure ne conviendra.
À propos, la vapeur de mercure est très toxique et 1 g de vapeur de mercure peut nuire gravement à la santé de toute personne. Lorsque vous travaillez avec du mercure, vous devez vous assurer que même la plus petite goutte de mercure ne se déverse pas.
Température critique
Comment transformer un gaz en liquide? Le calendrier d'ébullition répond à cette question. Vous pouvez transformer un gaz en liquide en diminuant la température ou en augmentant la pression.
Au 19ème siècle, l'augmentation de la pression semblait plus facile que l'abaissement de la température. Au début de ce siècle, le grand physicien anglais Mikhail Farad a réussi à compresser les gaz à des valeurs de pression de vapeur et à transformer ainsi beaucoup de gaz en liquide (chlore, dioxyde de carbone, etc.).
Cependant, certains gaz - hydrogène, azote, oxygène - n'ont pas pu être liquéfiés. Peu importe combien de pression ils ont augmenté, ils ne se sont pas transformés en liquide. On aurait pu penser que l'oxygène et les autres gaz ne pourraient pas être liquides. Ils ont été classés comme vrais ou constants.
En fait, les échecs ont été causés par une incompréhension d'une circonstance importante.
Considérez le liquide et la vapeur en équilibre, et réfléchissez à ce qui leur arrive lorsque le point d'ébullition augmente et, bien sûr, à l'augmentation correspondante de la pression. En d'autres termes, imaginez que le point du graphique en ébullition se déplace le long de la courbe. Il est clair que le liquide se dilate lorsque la température augmente et que sa densité diminue. Quant à la vapeur, l'augmentation du point d'ébullition? Bien sûr, cela contribue à son expansion, mais, comme nous l’avons déjà dit, la pression de vapeur saturée augmente beaucoup plus rapidement que le point d’ébullition. Par conséquent, la densité de vapeur ne diminue pas mais augmente rapidement avec l'augmentation du point d'ébullition.
Au fur et à mesure que la densité du liquide diminue et que la densité de la vapeur augmente, en remontant le long de la courbe d'ébullition, nous arriverons inévitablement au point où les densités du liquide et de la vapeur sont égales (Fig. 4.3).

Fig. 4.3
À ce point merveilleux - appelé critique, la courbe d'ébullition se brise. Puisque toutes les différences entre gaz et liquide sont liées à la différence de densité, les propriétés du liquide et du gaz deviennent identiques au point critique. Chaque substance a sa propre température critique et sa pression critique. Ainsi, pour l’eau, le point critique correspond à une température de 374 ° C et à une pression de 218,5 atm.
Si vous compressez un gaz dont la température est inférieure à la température critique, le processus de compression est représenté par une flèche traversant la courbe d'ébullition (Fig. 4.4). Cela signifie qu'au moment d'atteindre une pression égale à la pression de vapeur (le point d'intersection de la flèche avec la courbe d'ébullition), le gaz commencera à se condenser en liquide. Si notre vaisseau était transparent, nous verrions alors le début de la formation d’une couche liquide au fond du vaisseau. À pression constante, la couche de liquide se développera jusqu'à ce que tout le gaz se transforme en liquide. Une compression supplémentaire nécessitera une augmentation de la pression.

Fig. 4.4
La situation est complètement différente avec la compression d'un gaz dont la température est supérieure à la température critique. Le processus de compression peut à nouveau être représenté par une flèche allant de bas en haut. Mais maintenant, cette flèche ne traverse pas la courbe d'ébullition. Cela signifie que, une fois comprimée, la vapeur ne se condensera pas mais se condensera uniquement de manière continue.
À des températures supérieures à la température critique, il est impossible de séparer un liquide et un gaz par une interface: une substance homogène, sous une pression quelconque, sera sous le piston et il est difficile de dire quand il peut être appelé gaz et quand - liquide.
La présence d'un point critique montre qu'il n'y a pas de différence fondamentale entre les états liquide et gazeux. À première vue, il pourrait sembler qu'il n'y ait pas de différence fondamentale de ce type uniquement lorsqu'il s'agit de températures supérieures à la température critique. Ce n'est cependant pas le cas. L'existence d'un point critique indique la possibilité de transformer un liquide - un liquide réel pouvant être versé dans un verre - en un état gazeux sans aucune apparence d'ébullition.
Un tel chemin de transformation est illustré à la Fig. 4.4. Un fluide connu est marqué d'une croix. Si vous baissez un peu la pression (flèche vers le bas), cela fera bouillir, même si vous augmentez légèrement la température (flèche vers la droite). Mais nous agirons d’une manière complètement différente: nous allons compresser le liquide très fort, à une pression supérieure à la pression critique. Le point représentant l'état du liquide ira verticalement vers le haut. Ensuite, nous chauffons le liquide - ce processus est décrit par une ligne horizontale. Maintenant, une fois que nous sommes à droite de la température critique, nous allons baisser la pression à la pression initiale. Si vous réduisez maintenant la température, vous pouvez obtenir la vapeur réelle, qui pourrait être obtenue à partir de ce liquide d'une manière plus simple et plus courte.
Ainsi, il est toujours possible, en modifiant la pression et la température de contourner le point critique, d’obtenir de la vapeur au moyen de la transition continue d’un liquide à l’autre. Une telle transition continue ne nécessite ni ébullition ni condensation.
Les premières tentatives de liquéfaction de gaz tels que l'oxygène, l'azote et l'hydrogène ont donc été infructueuses, car on ne savait pas qu'il existait une température critique. Ces gaz ont des températures critiques très basses: azote -147 ° C, oxygène -119 ° C, hydrogène -240 ° C ou 33 K. Le détenteur du disque est de l’hélium, sa température critique est de 4,3 K. le liquide ne peut être qu’à sens unique - vous devez abaisser leur température en dessous de celle indiquée.
Obtenir des températures basses
Une réduction significative de la température peut être obtenue de différentes manières. Mais l’idée de toutes les méthodes est la même: il faut forcer le corps que nous voulons refroidir, pour dépenser son énergie interne.
Comment faire ça? Une solution consiste à faire bouillir le liquide sans laisser entrer la chaleur de l'extérieur. Pour cela, comme nous le savons, il est nécessaire de réduire la pression - de la réduire à la valeur de la pression de vapeur. La chaleur consommée par l'ébullition sera empruntée au liquide et à la température du liquide et de la vapeur, et avec elle la pression de vapeur diminuera. Par conséquent, pour que l'ébullition ne s'arrête pas et se produise plus rapidement, l'air doit être pompé en continu hors du récipient avec le liquide.
Cependant, la température chute au cours de ce processus, la limite est atteinte: au final, la pression de vapeur devient complètement insignifiante et même les pompes d’évacuation les plus puissantes ne peuvent pas créer la pression requise.
Pour continuer à baisser la température, il est possible, en refroidissant le gaz avec le liquide obtenu, de le transformer en un liquide à point d'ébullition inférieur.
Maintenant, le processus de pompage peut être répété avec la deuxième substance, et ainsi des températures plus basses peuvent être obtenues. Si nécessaire, un tel procédé "en cascade" permettant d'obtenir de basses températures peut être étendu.
C'est exactement ce qu'ils ont fait à la fin du siècle dernier. la liquéfaction des gaz a été effectuée par étapes: l’éthylène, l’oxygène, l’azote, l’hydrogène ont été convertis successivement en liquides - substances dont les points d’ébullition sont compris entre -103, -183, -196 et -253 ° С. Avec l'hydrogène liquide, vous pouvez obtenir le liquide dont le point d'ébullition est le plus bas - l'hélium (-269 ° C). Un voisin de gauche a aidé un voisin de droite.
Méthode de refroidissement en cascade depuis près de cent ans. En 1877, l’air liquide était obtenu par cette méthode.
Dans les années 1884-1885. l'hydrogène liquide a d'abord été obtenu. Finalement, vingt ans plus tard, la dernière forteresse fut prise: en 1908, Kamerlingh Onnes, dans la ville de Leiden en Hollande, transforma l'hélium en un liquide - une substance dont la température critique était la plus basse. Le 70e anniversaire de cette réalisation scientifique importante a récemment été célébré.
Pendant de nombreuses années, le laboratoire de Leiden a été le seul laboratoire "à basse température". Aujourd'hui, dans tous les pays, il existe des dizaines de laboratoires de ce type, sans oublier les usines produisant de l'azote, de l'oxygène et de l'hélium dans l'air à des fins techniques.
Le procédé d'obtention de basses températures en cascade est maintenant rarement utilisé. Dans les installations techniques, une autre méthode d'abaissement de l'énergie interne du gaz est utilisée pour abaisser la température: elles entraînent une expansion rapide du gaz et un travail dû à l'énergie interne.
Si, par exemple, de l'air comprimé à plusieurs atmosphères est laissé dans le détendeur, à la fin du travail de déplacement du piston ou de rotation de la turbine, l'air se refroidira si fort qu'il se transformera en liquide. Le dioxyde de carbone, s'il est rapidement libéré du cylindre, est si rapidement refroidi qu'il se transforme en "glace" à la volée.
Les gaz liquides sont largement utilisés dans la technologie. L'oxygène liquide est utilisé dans la technologie des explosifs en tant que composant du mélange de carburant dans les moteurs à réaction.
La liquéfaction de l'air est utilisée dans la technologie pour séparer les gaz constituant l'air.
Dans divers domaines techniques, il est nécessaire de travailler à une température d'air liquide. Mais pour de nombreuses études physiques, cette température n’est pas assez basse. En effet, si nous traduisons les degrés Celsius en échelle absolue, nous verrons que la température de l'air liquide correspond à environ 1/3 de la température ambiante. Pour les physiciens, les températures «d'hydrogène», c'est-à-dire de l'ordre de 14 à 20 K, et en particulier les températures «d'hélium», sont beaucoup plus intéressantes. La température la plus basse obtenue en pompant de l'hélium liquide est de 0,7 K.
Les physiciens ont réussi à se rapprocher beaucoup plus du zéro absolu. Actuellement, des températures dépassant le zéro absolu de seulement quelques millièmes de degré ont été obtenues. Cependant, ces ultra-basses températures sont obtenues de manière différente de celles décrites ci-dessus.
Ces dernières années, la physique des basses températures a donné naissance à une industrie spécialisée dans la production d’équipements permettant de maintenir de gros volumes à une température proche du zéro absolu; Des câbles de puissance ont été développés dont les barres conductrices fonctionnent à des températures inférieures à 10 K.
Liquide surfondu à la vapeur et surchauffé
Au point d'ébullition, la vapeur doit se condenser et se transformer en liquide. Cependant ;; Il s’avère que si la vapeur n’entre pas en contact avec le liquide et si la vapeur est très propre, il est alors possible d’obtenir une vapeur «sur-refroidie ou sursaturée» qui devrait déjà être devenue liquide.
La vapeur sursaturée est très instable. Parfois, il suffit de pousser ou de jeter des grains dans l’espace de la vapeur pour que la condensation retardée commence.
L’expérience montre que la condensation des molécules de vapeur est grandement facilitée par l’introduction de petites particules étrangères dans la vapeur. Dans l'air poussiéreux, il ne se produit pas de sursaturation en vapeur d'eau. La condensation peut être causée par des bouffées de fumée. Après tout, la fumée est constituée de petites particules solides. Une fois dans la vapeur, ces particules collectent des molécules proches d'elles-mêmes et deviennent des centres de condensation.
Ainsi, bien que instable, de la vapeur peut exister dans la plage de température, adaptée à la "durée de vie" du liquide.
Mais un liquide dans les mêmes conditions peut-il «vivre» dans la région de la vapeur? En d'autres termes, est-il possible de surchauffer un liquide?
Il s'avère que vous pouvez. Pour ce faire, il est nécessaire de s'assurer que les molécules liquides ne sortent pas de sa surface. Un remède radical consiste à éliminer la surface libre, c'est-à-dire à placer le liquide dans un récipient où il serait comprimé de tous les côtés par des parois solides. De cette manière, il est possible d’obtenir une surchauffe de l’ordre de plusieurs degrés, c’est-à-dire de supprimer le point décrivant l’état des liquides à droite de la courbe d’ébullition (Fig. 4.4).
La surchauffe est un déplacement du liquide dans la région de la vapeur. Par conséquent, une surchauffe du liquide peut être obtenue à la fois en fournissant de la chaleur et en réduisant la pression.
La dernière façon d'obtenir un résultat incroyable. De l'eau ou un autre liquide, parfaitement libéré des gaz dissous (ce n'est pas facile à faire), est placé dans un récipient avec un piston atteignant la surface du liquide. Le récipient et le piston doivent être mouillés avec du liquide. Si vous tirez maintenant le piston vers vous, de l'eau adhérant au fond du piston suivra. Mais une couche d’eau accrochée au piston entraînera la couche d’eau suivante, cette couche tirera la couche sous-jacente, ce qui provoquera l’étirement du liquide.
En fin de compte, la colonne d’eau va éclater (c’est la colonne d’eau, et non pas l’eau qui sortira du piston), mais cela se produira lorsque la force par unité de surface atteint des dizaines de kilogrammes. En d'autres termes, une pression négative de plusieurs dizaines d'atmosphères est créée dans le liquide.
Même à basses pressions positives, l'état de vapeur de la substance est stable. Et le liquide peut être amené à une pression négative. Vous ne pouvez pas imaginer un exemple plus frappant de «surchauffe».
La fonte
Aucun corps solide ne peut résister à toute augmentation de température. Tôt ou tard, une pièce solide se transforme en liquide; à droite, dans certains cas, nous ne pourrons pas atteindre le point de fusion - une décomposition chimique peut se produire.
Lorsque la température augmente, les molécules se déplacent plus intensément. Enfin, il arrive un moment où le maintien de l'ordre parmi les molécules «fortement balancées» devient impossible: un solide fond. Le point de fusion le plus élevé est le tungstène: 3380 ° C. L'or fond à 1063 ° C, le fer à 1539 ° C. Cependant, Le mercure, comme on le sait bien, fond déjà à une température de -39 ° C. Les substances organiques n'ont pas de point de fusion élevé. Le naphtalène fond à 80 ° C et le toluène à -94,5 ° C.
Il n’est pas difficile de mesurer le point de fusion du corps, surtout s’il fond dans la plage de température mesurée avec un thermomètre conventionnel. Il n'est pas nécessaire de suivre les yeux du corps en fusion. Il suffit de regarder la colonne de mercure du thermomètre. Jusqu'à ce que la fusion commence, la température corporelle augmente (Fig. 4.5). Dès que la fusion commence, l'élévation de température cesse et la température reste inchangée jusqu'à la fin du processus de fusion.

Fig. 4,5
Comme la conversion d'un liquide en vapeur, la transformation d'un solide en liquide nécessite de la chaleur. La chaleur requise pour cela s'appelle la chaleur latente de fusion. Par exemple, la fonte d’un kilogramme de glace nécessite 80 kcal.
La glace est l’un des corps à forte chaleur de fusion. La fonte des glaces nécessite, par exemple, 10 fois plus d'énergie que la même masse de plomb. Bien sûr, nous parlons de la fonte elle-même, nous ne disons pas ici qu'avant le début de la fonte du plomb, il doit être chauffé à + 327 ° C. En raison de la chaleur élevée de la fonte de la glace, la fonte de la neige ralentit. Imaginez que la chaleur en fusion soit 10 fois moins. Ensuite, les inondations printanières entraîneraient chaque année des catastrophes inimaginables.
La chaleur de fonte de la glace est donc excellente, mais elle est également faible si on la compare à une chaleur de vaporisation spécifique de 540 kcal / kg (sept fois moins). Cependant, cette différence est complètement naturelle. Lors du transfert de liquide dans de la vapeur, il faut séparer les molécules les unes des autres et, lors de la fusion, il suffit de détruire l’ordre dans l’arrangement des molécules, en les laissant à peu près aux mêmes distances. Il est clair que dans le second cas, moins de travail est nécessaire.
La présence d'un certain point de fusion est un signe important de substances cristallines. C’est précisément sur cette base qu’ils se distinguent facilement des autres solides appelés amorphes ou verres. Les verres sont présents parmi les substances inorganiques et organiques. Les vitres sont généralement faites de silicates de sodium et de calcium; souvent, du verre organique est placé sur le bureau (on l'appelle aussi plexiglas).
Les substances amorphes, contrairement aux cristaux, n'ont pas de point de fusion spécifique. Le verre ne fond pas mais se ramollit. Lorsqu'il est chauffé, un morceau de verre devient d'abord mou, il peut facilement être plié ou étiré; à une température plus élevée, la pièce commence à changer de forme sous l'influence de sa propre gravité. En se réchauffant, l'épaisse masse de verre visqueuse prend la forme du récipient dans lequel elle se trouve. Cette masse est d'abord épaisse comme du miel, puis comme de la crème sure, et finit par devenir un liquide presque aussi peu visqueux que de l'eau. Avec tous nos souhaits, nous ne pouvons pas indiquer ici une certaine température pour la transition d'un solide en un liquide. Cela s'explique par la différence fondamentale entre la structure du verre et la structure des corps cristallins. Comme mentionné ci-dessus, les atomes dans les corps amorphes sont localisés aléatoirement. La structure du verre ressemble à celle des liquides: déjà dans le verre solide, les molécules sont disposées de manière aléatoire. Cela signifie qu'une augmentation de la température du verre n'augmente que la plage de vibrations de ses molécules, leur donnant progressivement de plus en plus de liberté de mouvement. Par conséquent, le verre se ramollit progressivement et ne révèle pas de transition nette "solide" - "liquide", caractéristique du passage de la disposition des molécules dans un ordre strict à une disposition aléatoire.
En ce qui concerne la courbe d'ébullition, nous avons dit que le liquide et la vapeur peuvent, bien que dans un état instable, habiter les zones des autres personnes - la vapeur peut être refroidie et transférée à gauche de la courbe d'ébullition, le liquide peut être surchauffé et aspiré à droite de cette courbe.
Des phénomènes similaires sont-ils possibles dans le cas d'un cristal avec un liquide? Il s'avère que l'analogie est incomplète.
Si le cristal est chauffé, il commencera à fondre à son point de fusion. Il ne sera pas possible de surchauffer le cristal. Au contraire, lors du refroidissement d'un liquide, il est possible, si certaines mesures sont prises, de glisser relativement facilement à travers la température de fusion. Dans certains liquides, des sous-refroidissements importants peuvent être obtenus. Il existe même des liquides faciles à sous-refroidir, mais difficiles à faire cristalliser. Au fur et à mesure que ce fluide refroidit, il devient plus visqueux et durcit finalement sans cristalliser. C'est du verre.
Vous pouvez sous-refroidir et arroser. Les gouttelettes de brouillard ne peuvent pas geler même en cas de gelées sévères. Si une substance cristalline est jetée dans un liquide en surfusion - une graine, la cristallisation commence immédiatement.
Enfin, dans de nombreux cas, une cristallisation retardée peut commencer par un tremblement ou par d'autres événements aléatoires. On sait, par exemple, que la glycérine cristalline a d'abord été obtenue par transport ferroviaire. Après de longues années, le verre peut commencer à cristalliser (devitrilize, ou "shake", comme on dit dans la technique).
Comment faire pousser un cristal
Presque toutes les substances peuvent produire des cristaux dans certaines conditions. Les cristaux peuvent être obtenus à partir d'une solution ou d'une masse fondue d'une substance donnée, ainsi que de sa vapeur (par exemple, des cristaux d'iode en forme de diamant noir précipitent facilement de sa vapeur à la pression normale sans transition intermédiaire vers un état liquide).
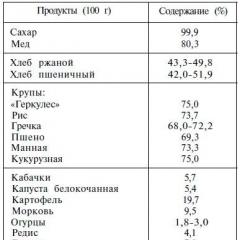
Commencez par dissoudre le sel de table ou le sucre dans l'eau. À la température ambiante (20 ° C), vous ne pourrez dissoudre que 70 g de sel dans un verre à facettes. Les autres additifs au sel ne se dissolvent pas et ne se déposent pas au fond sous forme de sédiment. Une solution dans laquelle plus aucune dissolution ne se produit est appelée saturée. .Si la température change, le degré de solubilité de la substance changera également. Tout le monde sait que la plupart des substances dissolvent l'eau chaude beaucoup plus facilement que l'eau froide.
Imaginez maintenant - que vous ayez préparé une solution saturée de sucre, par exemple, à une température de 30 ° C et que vous commenciez à la refroidir à 20 ° C. À 30 ° C, vous avez pu dissoudre 223 g de sucre dans 100 g d’eau, 205 g à 20 ° C. Puis, refroidis de 30 à 20 ° C, 18 g seront "superflus" et, comme on dit, décrochés. Ainsi, l'une des méthodes possibles pour produire des cristaux consiste à refroidir une solution saturée.
Vous pouvez faire autrement. Préparez une solution salée saturée et laissez-la dans un verre ouvert. Au bout d'un moment, vous découvrirez l'apparition de cristaux. Pourquoi se sont-ils formés? Une observation attentive montrera que, parallèlement à la formation de cristaux, un autre changement s’est produit: la quantité d’eau a diminué. L'eau s'est évaporée et la substance "en excès" est apparue dans la solution. Une autre façon de former des cristaux consiste donc à évaporer une solution.
Comment se passe la formation de cristaux à partir de la solution?
Nous avons dit que les cristaux "précipitent" hors de la solution; Est-ce que cela doit être compris de manière à ce qu'il n'y ait plus de cristal pendant une semaine et qu'en un instant, il apparaisse soudainement? Non, ce n'est pas le cas: les cristaux se développent. Bien entendu, il n’est pas possible de détecter à l’œil les tout premiers moments de la croissance. Premièrement, peu de molécules ou d’atomes du soluté en mouvement aléatoire sont assemblés dans l’ordre approximatif qui est nécessaire pour former le réseau cristallin. Un tel groupe d'atomes ou de molécules s'appelle un embryon.
L'expérience montre que les embryons se forment plus souvent lorsque de minuscules particules de poussière étrangères sont présentes dans la solution. La cristallisation la plus rapide et la plus facile commence lorsqu'un petit germe cristallin est placé dans une solution saturée. Dans ce cas, la sélection d'un solide dans une solution ne consistera pas en la formation de nouveaux cristaux, mais en la croissance de la graine.
La croissance de l'embryon ne diffère pas, bien sûr, de la croissance de la graine. La signification de l’utilisation de la graine est qu’elle «tire» la substance libérée sur elle-même et empêche ainsi la formation simultanée d’un grand nombre de noyaux. Si beaucoup de noyaux sont formés, ils vont interférer les uns avec les autres pendant la croissance et ne nous permettront pas d’obtenir de gros cristaux.
Comment les portions d'atomes ou de molécules libérées de la solution sont-elles réparties à la surface de l'embryon?
L’expérience montre que la croissance d’une graine ou d’une graine consiste à déplacer les faces parallèles entre elles dans une direction perpendiculaire à la face. Dans ce cas, les angles entre les faces restent constants (nous savons déjà que la constance des angles est le signe le plus important d’un cristal, résultant de sa structure en treillis).
Sur la fig. 4.6, les contours de trois cristaux de la même substance sont donnés au cours de leur croissance. Des images similaires peuvent être observées au microscope. Dans le cas présenté à gauche, le nombre de faces pendant la croissance est maintenu. La photo du milieu donne un exemple de l'apparition d'un nouveau visage (en haut à droite) et encore de sa disparition.

Fig. 4.6
Il est très important de noter que le taux de croissance des faces, c’est-à-dire la vitesse de déplacement parallèle, est différent pour les différentes faces. Dans le même temps, ce sont précisément les visages qui «bougent» (disparaissent) qui se déplacent le plus rapidement, par exemple le bas du visage gauche dans la figure du milieu. Au contraire, les visages à croissance lente se révèlent être les plus larges, comme on dit, les plus développés.
Ceci est particulièrement visible dans la dernière figure. La puce sans forme prend la même forme que les autres cristaux, précisément à cause de l'anisotropie du taux de croissance. Des visages bien définis se développent d'autant plus fortement aux dépens des autres et confèrent au cristal une forme caractéristique de tous les échantillons de cette substance.
De très belles formes de transition sont observées quand une balle est prise comme une graine, et la solution est alternativement légèrement refroidie et chauffée. Lorsqu'elle est chauffée, la solution devient insaturée et la graine est partiellement dissoute. Le refroidissement conduit à la saturation de la solution et à la croissance de la graine. Mais les molécules s'installent différemment, comme si elles privilégiaient certains endroits. La substance est donc transférée d'un endroit à l'autre de la balle.
Premièrement, de petites faces en forme de cercles apparaissent à la surface de la balle. Les cercles augmentent progressivement et, au contact les uns des autres, se confondent le long des bords droits. La balle se transforme en polyèdre. Ensuite, certains visages se superposent à d'autres, certains se recouvrent et le cristal acquiert sa forme caractéristique (Fig. 4.7).

Fig. 4.7
En observant la croissance des cristaux, la principale caractéristique de la croissance est frappante - le mouvement parallèle des faces. Il se trouve que la substance libérée accumule le visage en couches: jusqu'à ce qu'une couche soit terminée, la suivante ne commence pas à être construite.
Sur la fig. La figure 4.8 montre l'empilement "non fini" d'atomes. Dans laquelle des positions indiquées par les lettres le nouvel atome sera-t-il le plus fermement maintenu, attaché au cristal? Sans aucun doute, dans A, puisqu'il expérimente ici l'attraction des voisins sur trois côtés, alors que B est sur deux côtés et que C n'est que d'un côté. Par conséquent, la colonne est d'abord complétée, puis tout l'avion, puis commence la pose d'un nouvel avion.

Fig. 4.8
Dans un certain nombre de cas, les cristaux sont formés à partir d'une masse fondue - à partir d'une masse fondue. Dans la nature, cela est accompli à une échelle énorme: basaltes, granites et beaucoup d'autres roches sont nés du magma de feu.
Nous commençons à chauffer une substance cristalline, telle que le sel gemme. Jusqu'à 804 ° C, les cristaux de sels minéraux changeront peu: ils ne se dilatent que légèrement et la substance reste solide. Un thermomètre installé dans un récipient contenant une substance montre une augmentation continue de la température lorsqu'il est chauffé. À 804 ° C, nous trouverons immédiatement deux nouveaux phénomènes interconnectés: la substance commencera à fondre et l'élévation de température cessera. Jusqu'à ce que toute la substance devienne liquide; la température ne changera pas; une nouvelle hausse de température chauffe déjà le liquide. Toutes les substances cristallines ont un certain point de fusion. La glace fond à 0 ° C, le fer à 1527 ° C, le mercure à -39 ° C, etc.
Comme nous le savons déjà, dans chaque cristal, les atomes ou les molécules d’une substance forment un empilement ordonné et produisent de petites vibrations autour de leurs positions médianes. À mesure que le corps se réchauffe, la vitesse des particules qui oscillent augmente avec l'amplitude des oscillations. Cette augmentation de la vitesse des particules avec l’augmentation de la température est l’une des lois fondamentales de la nature, qui s’applique à la matière dans tous les états - solide, liquide ou gazeux.
Lorsque le cristal atteint une certaine température suffisamment élevée, les vibrations de ses particules deviennent si énergiques qu’il devient impossible de les agencer proprement - le cristal fond. Au début de la fusion, la chaleur fournie n'est plus utilisée pour augmenter la vitesse des particules mais pour détruire le réseau cristallin. Par conséquent, l'élévation de température cesse. Le chauffage ultérieur est une augmentation de la vitesse des particules de fluide.
Dans le cas de la cristallisation à partir d'une fusion qui nous intéresse, les phénomènes ci-dessus sont observés dans l'ordre inverse: à mesure que le liquide se refroidit, ses particules ralentissent leur mouvement chaotique; Lorsqu'une certaine température suffisamment basse est atteinte, la vitesse de la particule est déjà si faible que certaines d'entre elles, sous l'action de forces d'attraction, commencent à se lier les unes aux autres en formant des noyaux cristallins. Jusqu'à ce que tout le matériau cristallise, la température reste constante. Cette température est généralement la même que le point de fusion.
Si vous ne prenez pas de mesures spéciales, la cristallisation à partir de la fusion commencera immédiatement dans de nombreux endroits. Les cristaux se développeront sous la forme de polyèdres réguliers qui leur sont inhérents exactement de la même manière que celle décrite ci-dessus. Cependant, la croissance libre ne dure pas longtemps: en augmentant, les cristaux se rencontrent, aux endroits de contact, la croissance s'arrête et le corps durci reçoit une structure granulaire. Chaque grain est un cristal cristallin séparé, qui n'a pas réussi à prendre sa forme normale.
Selon les conditions, et surtout la vitesse de refroidissement, un corps solide peut avoir des grains plus ou moins gros: plus le refroidissement est lent, plus les grains sont gros. La taille des grains des corps cristallins va du millionième de centimètre à plusieurs millimètres. Dans la plupart des cas, une structure cristalline granulaire peut être observée au microscope. Les solides ont généralement une telle structure cristalline.
Le processus de solidification des métaux présente un grand intérêt pour la technologie. Les physiciens ont étudié très en détail les événements survenant lors de la coulée et de la solidification du métal dans des moules.
Pendant la solidification, la plupart du temps, des monocristaux ressemblant à des arbres, appelés dendrites, se développent. Dans d'autres cas, les dendrites sont orientés de manière aléatoire, dans d'autres cas, parallèlement les uns aux autres.
Sur la fig. La figure 4.9 montre les stades de croissance d'une seule dendrite. Avec ce comportement, la dendrite peut proliférer avant d’en rencontrer une autre similaire. Ensuite, nous ne trouverons pas de dendrites dans le casting. Les événements peuvent se développer d'une autre manière: les dendrites peuvent se rencontrer et se développer les uns aux autres (branches de l'une entre les branches de l'autre) tant qu'ils sont encore «jeunes».

Fig. 4.9
Ainsi, il peut se produire des coulées dont les grains (représentés sur la figure 2.22) ont une structure très différente. Et les propriétés des métaux dépendent essentiellement de la nature de cette structure. Vous pouvez contrôler le comportement du métal pendant la solidification en modifiant le taux de refroidissement et le système d'évacuation de la chaleur.
Parlons maintenant de la façon de faire pousser un grand cristal unique. Il est clair que des mesures sont nécessaires pour que le cristal se développe à partir d'un endroit. Et si plusieurs cristaux ont commencé à se développer, il est en tout cas nécessaire de s’assurer que les conditions de croissance ne sont favorables que pour l’un d’eux.
Ici, par exemple, ce qu’ils font lors de la croissance de cristaux de métaux à bas point de fusion. Le métal est fondu dans un tube de verre à extrémité emboutie. Un tube suspendu à un fil à l'intérieur d'un four cylindrique vertical est lentement abaissé. L'extrémité tirée sort progressivement du four et se refroidit. La cristallisation commence. Au début, plusieurs cristaux se forment, mais ceux qui poussent sur le côté s'approchent de la paroi du tube et ralentissent leur croissance. Dans des conditions favorables, il ne subsistera qu'un cristal qui se développera dans l'axe du tube, c'est-à-dire profondément dans la masse fondue. Lorsque le tube à essai s'abaisse, de nouvelles parties de la masse fondue tombant dans la région à basse température «alimenteront» ce monocristal. Par conséquent, de tous les cristaux, il survit seul; à mesure que le tube tombe, il continue de croître le long de son axe. À la fin, tout le métal en fusion se solidifie sous la forme d'un monocristal.
La même idée sous-tend la culture des cristaux de rubis réfractaires. La poudre fine de la substance est pulvérisée à travers la flamme. Les poudres fondent; de minuscules gouttes tombent sur une base réfractaire d'une très petite surface, formant de nombreux cristaux. Avec la chute de gouttes supplémentaires sur le support, tous les cristaux grossissent, mais seule celle qui se trouve dans la position la plus favorable pour "recevoir" les gouttes qui tombent grandit.
Pourquoi faut-il de gros cristaux?
L'industrie et la science ont souvent besoin de gros monocristaux. Les cristaux de sel de Rochelle et de quartz, qui présentent la propriété remarquable de convertir les actions mécaniques (par exemple, la pression) en une tension électrique, revêtent une grande importance pour la technologie.
L’industrie optique a besoin de gros cristaux de calcite, de sel gemme, de fluorite, etc.
Pour l’industrie horlogère, il faut des cristaux de rubis, de saphirs et d’autres pierres précieuses. Le fait est que chaque pièce mobile d’une montre ordinaire fait jusqu’à 20 000 fluctuations par heure. Une charge aussi lourde impose des exigences exceptionnellement élevées en termes de qualité des extrémités des essieux et des paliers. L'abrasion sera la plus faible lorsqu'un rubis ou un saphir sert de palier à la pointe de l'axe avec un diamètre de 0,07 à 0,15 mm. Les cristaux artificiels de ces substances sont très durables et très peu abrasés par l'acier. Il est remarquable que les pierres artificielles se révèlent meilleures que les mêmes pierres naturelles.
Cependant, la croissance des monocristaux de semi-conducteurs - silicium et germanium - revêt la plus grande importance pour l’industrie.
L'effet de la pression sur la température de fusion
Si vous modifiez la pression, la température de fusion changera également. Nous avons rencontré le même schéma lorsque nous avons parlé de l'ébullition. Pression plus élevée; plus le point d'ébullition est élevé. En règle générale, cela est également vrai pour la fusion. Cependant, un petit nombre de substances ont un comportement anormal: leur point de fusion diminue avec l'augmentation de la pression.
Le fait est que la grande majorité des solides sont plus denses que leurs liquides. L'exception à cette dravil concerne précisément les substances dont la température de fusion ne change pas normalement avec la pression, par exemple l'eau. La glace est plus légère que l'eau et sa température de fusion diminue à mesure que la pression augmente.
La compression contribue à un état plus dense. Si un solide est plus dense qu'un liquide, la compression contribue à la solidification et interfère avec la fusion. Mais si la compression empêche la fusion de fondre, cela signifie que la substance reste solide, alors que plus tôt à cette température elle fondrait déjà, c'est-à-dire que lorsque la pression augmente, la température de fusion augmente. Dans le cas anormal, le liquide est plus dense qu'un solide et la pression favorise la formation de liquide, c'est-à-dire qu'elle abaisse le point de fusion.
L'effet de la pression sur la température de fusion est beaucoup moins important que l'effet similaire pour l'ébullition. Une augmentation de pression supérieure à 100 kgf / cm 2 abaisse le point de fusion de la glace de 1 ° C.
Pourquoi les patins ne glissent-ils que sur la glace, mais pas sur un parquet tout aussi lisse? Apparemment, la seule explication est la formation d’eau qui lubrifie la crête. Pour comprendre la contradiction apparue, vous devez vous rappeler les points suivants: des patins stupides glissent très mal sur la glace. Les patins doivent être affûtés de manière à couper la glace. Dans ce cas, seul le bord de la crête appuie sur la glace. La pression sur la glace atteint des dizaines de milliers d'atmosphères, la glace fond encore.
Évaporation de solides
Quand ils disent "la substance s'évapore", ils signifient généralement que le liquide s'évapore. Mais les solides peuvent aussi s'évaporer. Parfois, l’évaporation des solides est appelée sublimation.
Un solide en évaporation est, par exemple, le naphtalène. Le naphtalène fond à 80 ° C et s'évapore à la température ambiante. C'est cette propriété du naphtalène qui lui permet d'être utilisé pour exterminer les papillons de nuit.
Un manteau de fourrure recouvert de naphtalène est imbibé de vapeur de naphtalène et crée une atmosphère que le papillon ne peut supporter. Toute odeur de solide est sublime dans une large mesure. Après tout, l’odeur est créée par des molécules qui sont sorties de la substance et ont atteint notre nez. Cependant, les cas plus fréquents se produisent lorsqu'une substance est sublimée dans une faible mesure, parfois à un degré qui ne peut pas être détecté même par des études très approfondies. En principe, toute substance solide (n'importe laquelle, même le fer ou le cuivre) s'évapore. Si nous ne détectons pas la sublimation, cela signifie simplement que la densité de la vapeur saturante est très faible.
Vous pouvez vous assurer qu'un certain nombre de substances ayant une odeur âcre à la température ambiante la perdent à basse température.
La densité de vapeur saturée en équilibre avec un solide augmente rapidement avec la température. Nous avons illustré ce comportement par la courbe de la glace illustrée à la Fig. 4.10. C'est vrai, la glace ne sent pas ...

Fig. 4.10
Augmenter de manière significative la densité de vapeur saturée d'un solide dans la plupart des cas est impossible pour une raison simple - la substance va fondre plus tôt.
La glace s'évapore également. Ceci est bien connu des femmes au foyer qui étanchent les vêtements mouillés en cas de gelée. «L’eau gèle, puis la glace s’évapore et le linge s’avère sec.
Triple point
Il existe donc des conditions dans lesquelles vapeur, liquide et cristal peuvent exister en équilibre par paires. Les trois états peuvent-ils être en équilibre? Un tel point du diagramme pression-température existe, il est appelé triple. Où est-elle située?
Si vous placez de l'eau avec de la glace en suspension dans un récipient fermé à zéro degré, alors les vapeurs d'eau (et de "glace") commenceront à s'écouler dans l'espace libre. À une pression de vapeur de 4,6 mm RT. Art. l'évaporation cessera et la saturation commencera. Maintenant, les trois phases - glace, eau et vapeur - seront dans un état d'équilibre. C'est le triple point.
Les relations entre les différents états sont clairement et distinctement illustrées dans le diagramme pour l'eau présenté à la Fig. 4.11.

Fig. 4.11
Un tel diagramme peut être construit pour n'importe quel organisme.
Les courbes de la figure nous sont familières - il s’agit des courbes d’équilibre entre glace et vapeur, glace et eau, eau et vapeur. Verticalement, comme d'habitude, la pression est déposée, horizontale - température.
Trois courbes se croisent en un point triple et divisent le diagramme en trois zones: les espaces de vie composés de glace, d’eau et de vapeur d’eau.
Un diagramme d'état est une référence concise. Son but est de répondre à la question de savoir quel état du corps est stable à telle pression et telle température.
Si de l'eau ou de la vapeur est placée dans les conditions de la "région de gauche", elles deviendront de la glace. Si un liquide ou un solide est introduit dans la "région inférieure", de la vapeur sera produite. Dans la "bonne zone", la vapeur se condensera et la glace fondra.
Le diagramme de phase vous permet de déterminer immédiatement ce qu'il adviendra de la substance lors du chauffage ou de la compression. Le chauffage à pression constante est représenté dans le diagramme par une ligne horizontale. Un point décrivant l'état du corps se déplace le long de cette ligne de gauche à droite.
La figure montre deux de ces lignes, l’une chauffant à la pression normale. La ligne se situe au-dessus du point triple. Par conséquent, il coupe d'abord la courbe de fusion, puis en dehors du dessin, et la courbe d'évaporation. La glace à la pression normale fondra à une température de 0 ° C et l’eau résultante bouillira à 100 ° C.
Sinon, il s'agira de glace chauffée à très basse pression, par exemple légèrement en dessous de 5 mm de mercure. Art. Le processus de chauffage est représenté par une ligne allant au-dessous du point triple. Les courbes de fusion et d'ébullition ne se croisent pas avec cette ligne. Avec une pression aussi faible, le chauffage entraînera une transition directe de la glace en vapeur.
Sur la fig. 4.12 Le même diagramme montre quel phénomène intéressant se produira si la vapeur d’eau est comprimée dans l’état marqué d’une croix sur la figure. Au début, la vapeur se transformera en glace, puis elle fondra. La figure vous permet de dire immédiatement à quelle pression le cristal commence à croître et à quel moment la fusion se produira.

Fig. 4.12
Les diagrammes d'état de toutes les substances sont semblables. D'importantes différences, d'un point de vue matériel, résultent du fait que l'emplacement du point triple sur le diagramme peut être très différent pour différentes substances.
Après tout, nous existons à proximité de «conditions normales», c’est-à-dire d’abord à une pression proche de la même atmosphère. La façon dont le point triple de la substance est situé par rapport à la ligne de pression normale est très importante pour nous.
Si la pression au point triple est inférieure à la pression atmosphérique, pour nous qui vivons dans des conditions "normales", la substance fait référence à la fusion. Lorsque la température augmente, il se transforme d'abord en liquide, puis bout.
Dans le cas contraire - lorsque la pression au point triple est supérieure à la pression atmosphérique - nous ne verrons pas le liquide chauffé, le solide se transformera directement en vapeur. C'est ainsi que se comporte la neige carbonique, ce qui est très pratique pour les vendeurs de crème glacée. Les briquettes de crème glacée peuvent être déplacées avec des morceaux de "neige carbonique" et ne craignez pas que la crème glacée devienne humide. La "neige carbonique" est un dioxyde de carbone solide CO2 0. Le triple point de cette substance se situe à 73 atm. Par conséquent, lorsque le CO 2 solide est chauffé, le point représentant son état se déplace horizontalement, ne croisant que la courbe d'évaporation du solide (ainsi que pour la glace ordinaire sous une pression d'environ 5 mm de Hg).
Nous avons déjà expliqué au lecteur comment un degré de température est déterminé sur l’échelle de Kelvin ou, comme le système SI l’a maintenant besoin de le dire, un kelvin. Cependant, il s'agissait du principe de détermination de la température. Tous les instituts de métrologie ne disposent pas de thermomètres à gaz parfaits. Par conséquent, l'échelle de température est construite en utilisant des points d'équilibre fixés par la nature entre différents états de la matière.
Un triple point d'eau joue un rôle particulier à cet égard. Le degré Kelvin est maintenant défini comme la 273,16e partie de la température thermodynamique du point triple de l’eau. Le point triple de l’oxygène est pris à 54,361 K. La température de solidification de l’or est fixée à 1337,58 K. Ces points de référence permettent d’étalonner avec précision tout thermomètre.
Les mêmes atomes, mais ... des cristaux différents
Le graphite doux noir mat avec lequel nous écrivons et le diamant brillant, dur, transparent et dur, sont construits à partir des mêmes atomes de carbone. Pourquoi les propriétés de ces deux substances de même composition sont-elles si différentes?
Rappelez-vous le réseau de graphite en couches, dont chaque atome a trois voisins les plus proches, et le réseau de diamant, dont l’atome a quatre voisins les plus proches. Cet exemple montre clairement que les propriétés des cristaux sont déterminées par l'arrangement mutuel des atomes. Les creusets réfractaires sont en graphite, supportant des températures allant de deux à trois mille degrés et le diamant brûle à des températures supérieures à 700 ° C; la densité de diamant est de 3,5 et le graphite de 2,3; le graphite conduit le courant électrique, le diamant ne conduit pas, etc.
Non seulement le carbone a cette caractéristique de produire différents cristaux. Presque tous les éléments chimiques, et non seulement un élément, mais aussi toute substance chimique, peuvent exister en plusieurs variétés. On connaît six variétés de glace, neuf variétés de soufre, quatre variétés de fer.
Lors de l'examen du diagramme d'état, nous n'avons pas parlé des différents types de cristaux et avons dessiné une seule région d'un solide. Et cette zone pour de très nombreuses substances est divisée en sections, chacune correspondant à un certain "grade" d'un solide ou, comme on dit, à une certaine phase solide (une certaine modification cristalline).
chaque phase cristalline a sa propre région d'état stable, limitée par une certaine plage de pressions et de températures. Les lois de transformation d'une espèce cristalline en une autre sont les mêmes que les lois de fusion et d'évaporation.
Pour chaque pression, vous pouvez spécifier la température à laquelle les deux types de cristaux vont coexister pacifiquement. Si la température est élevée, un cristal d'un type deviendra un cristal du deuxième type. Si vous baissez la température, la transformation inverse se produira.
Pour que le soufre rouge jaunisse à la pression normale, une température inférieure à 110 ° C est nécessaire. Au-dessus de cette température, jusqu’au point de fusion, la disposition des atomes caractéristiques du soufre rouge est stable. La température baisse, les vibrations atomiques diminuent et, à partir de 110 ° C, la nature trouve un arrangement d'atomes plus commode. Il y a une transformation d'un cristal en un autre.
Personne n'a proposé un nom pour six glaces différentes. Alors ils disent: glace un, glace deux, ..., glace sept. Qu'en est-il sept, si seulement six variétés? Le fait est que la glace quatre n'a pas été trouvée au cours d'expériences répétées.
Si vous compressez de l'eau à une température d'environ zéro, une pression d'environ 2000 atmosphères se forme alors, et une pression d'environ 6000 atmosphères - six.
La glace deux et la glace trois sont stables à des températures inférieures à zéro degré.
Glace sept - glace chaude; cela se produit lorsque l'eau chaude est comprimée à des pressions d'environ 20 000 atm.
Toute la glace, sauf ordinaire, est plus lourde que l'eau. La glace produite dans des conditions normales se comporte anormalement; au contraire, la glace obtenue dans des conditions autres que la normale se comporte normalement.
Nous disons que chaque modification cristalline a une région d'existence spécifique. Mais si oui, alors comment le graphite et le diamant existent-ils dans des conditions identiques?
Une telle "anarchie" est très courante dans le monde cristallin. La possibilité de vivre dans des conditions "étrangères" aux cristaux est presque la règle. Si vous devez recourir à diverses astuces pour transférer de la vapeur ou du liquide dans d’autres domaines de l’existence, le cristal, au contraire, ne réussira presque jamais à vous contraindre à rester dans les limites qui lui sont attribuées par la nature.
La surchauffe et la surfusion de cristaux s’expliquent par la difficulté de convertir un ordre en un autre dans des conditions de surpeuplement extrême. Le soufre jaune doit virer au rouge à 95,5 ° C. Avec un chauffage plus ou moins rapide, nous allons "glisser à travers" ce point de conversion et amener la température à un point de fusion de soufre de 113 ° C.
La vraie température de transformation est plus facilement détectée par le contact de cristaux. S'ils se superposent étroitement et sont maintenus à une température de 96 ° C, le jaune sera mangé en rouge et à 95 ° C, le jaune absorbera le rouge. Contrairement à la transition cristal-liquide, les transformations cristal-cristal sont généralement retardées à la fois lors du refroidissement excessif et de la surchauffe.
Dans certains cas, nous avons affaire à des états de la matière qui sont supposés vivre à des températures complètement différentes.
L'étain blanc doit virer au gris lorsque la température baisse à + 13 ° C. Nous traitons habituellement avec de l'étain blanc et savons que rien ne se fait en hiver. Il résiste parfaitement au sous-refroidissement de 20 à 30 degrés. Cependant, durant les hivers rigoureux, l’étain blanc devient gris. L'ignorance de ce fait était l'une des circonstances qui ont ruiné l'expédition de Scott au pôle Sud (1912). Le carburant liquide récupéré par l'expédition se trouvait dans des navires soudés à l'étain. Par grand temps froid, l’étain blanc se transformait en poudre grise - les vaisseaux étaient cassés; et le carburant déversé. Pas étonnant que l'apparition de taches grises sur l'étain blanc s'appelle la peste de l'étain.
Comme dans le cas du soufre, l'étain blanc peut être converti en gris à une température juste inférieure à 13 ° C ;; si seulement un minuscule grain de variété grise atteint un objet en étain.
L'existence de plusieurs variétés de la même substance et les retards dans leurs transformations mutuelles revêtent une grande importance pour la technologie.
À la température ambiante, les atomes de fer forment un réseau cubique centré sur le corps, dans lequel les atomes occupent des emplacements situés aux sommets et au centre du cube. Chaque atome a 8 voisins. À haute température, les atomes de fer forment un «tassement» plus dense - chaque atome a 12 voisins. Le fer à 8 voisins est doux, le fer à 12 voisins est solide. Il s’avère qu’il est possible d’obtenir du fer du deuxième type à la température ambiante. Cette méthode - la trempe - est largement utilisée en métallurgie.
La trempe s’effectue très simplement: un objet métallique est chauffé au rouge puis jeté à l’eau ou à l’huile. Le refroidissement est tellement rapide que la transformation d'une structure stable à haute température n'a pas le temps de se produire. Ainsi, une structure à haute température existera pendant une durée illimitée dans des conditions inhabituelles: la recristallisation dans une structure stable est si lente qu'elle est presque invisible.
En parlant de durcissement du fer, nous n’avions pas tout à fait raison. L’acier est trempé, c’est-à-dire du fer, contenant des fractions de pour cent de carbone. La présence de très petites impuretés de carbone retarde la conversion du fer solide en fer tendre et permet son durcissement. En ce qui concerne le fer complètement pur, il ne peut pas être tempéré - la transformation de la structure parvient à se produire même avec le refroidissement le plus brutal.
En fonction du type de diagramme d'état, de pressions ou de températures variables, une transformation est réalisée.
De nombreuses transformations d'un cristal en un cristal sont observées avec un changement de pression seul. De cette manière, du phosphore noir a été obtenu.

Fig. 4.13
Il était possible de transformer le graphite en diamant en utilisant uniquement une température élevée et une pression élevée. Sur la fig. 4.13 est un diagramme de carbone. À des pressions inférieures à dix mille atmosphères et à des températures inférieures à 4000 K, le graphite est une modification stable. Ainsi, un diamant vit dans des conditions "extraterrestres" et peut donc être transformé en graphite sans trop de difficultés. Mais le problème inverse est d’intérêt pratique. La conversion du graphite en diamant n’est pas possible avec une seule augmentation de pression. La transition de phase à l'état solide est apparemment trop lente. L’apparence du diagramme d’états suggère la solution appropriée: augmenter simultanément la pression et la chaleur. Ensuite, nous obtenons (le coin droit du diagramme) du carbone fondu. En le refroidissant à haute pression, nous devons pénétrer dans la zone des diamants.
La faisabilité pratique d'un tel procédé a été prouvée en 1955 et le problème est actuellement considéré comme techniquement résolu.
Liquide incroyable
Si vous abaissez la température corporelle, il finira par se durcir ou acquérir une structure cristalline. Peu importe à quelle pression se produit le refroidissement. Ce fait semble tout à fait naturel et compréhensible du point de vue des lois de la physique, avec lesquelles nous avons déjà rencontré. En effet, en abaissant la température, nous réduisons l'intensité du mouvement thermique. Lorsque le mouvement des molécules devient si faible qu'il n'interfère plus avec les forces d'interaction qui les unissent, les molécules s'alignent de manière ordonnée - elles forment un cristal. Un refroidissement supplémentaire prendra toute l’énergie de leur mouvement des molécules, et au zéro absolu, la substance devrait exister sous la forme de molécules au repos disposées en réseau régulier.
L’expérience montre que toutes les substances se comportent de la sorte. Tout sauf une chose: l'hélium est un «monstre».
Nous avons déjà communiqué au lecteur des informations sur l'hélium. Helium est un champion en termes de température critique. Pas une seule substance n'a une température critique inférieure à 4,3 K. Cependant, ce seul enregistrement ne signifie rien d'étonnant. Une autre chose est frappante: le refroidissement de l'hélium en dessous d'une température critique, après avoir presque atteint le zéro absolu, nous n'obtiendrons pas d'hélium solide. L'hélium reste liquide même au zéro absolu.
Le comportement de l'hélium est complètement inexplicable du point de vue des lois du mouvement énoncées par nous et est l'un des signes de la validité limitée de ces lois de la nature qui semblaient universelles.
Si le corps est liquide, ses atomes sont en mouvement. Mais après avoir refroidi le corps à zéro absolu, nous en avons retiré toute l'énergie du mouvement. Nous devons admettre que l'hélium a une telle énergie de mouvement qu'il est impossible de supprimer. Cette conclusion est incompatible avec les mécanismes que nous avons utilisés jusqu'à présent. Selon cette mécanique que nous avons étudiée, le mouvement d’un corps peut toujours être freiné jusqu’à un arrêt complet, lui enlevant toute l’énergie cinétique; de la même manière, le mouvement des molécules peut être arrêté en prenant de l'énergie quand elles entrent en collision avec les parois d'un vaisseau refroidi. Pour l'hélium, de tels mécanismes ne sont clairement pas adaptés.
Le comportement "étrange" de l'hélium est une indication du fait d'une grande importance. Nous avons d'abord rencontré l'impossibilité d'appliquer les lois fondamentales de la mécanique dans le monde des atomes, établies par une étude directe du mouvement des corps visibles, lois qui semblaient être le fondement inébranlable de la physique.
Le fait que l'hélium "refuse" de se cristalliser au zéro absolu ne peut en aucun cas être concilié avec la mécanique que nous avons étudiée jusqu'à présent. La contradiction que nous avons rencontrée pour la première fois - l'insubordination du monde des atomes vis-à-vis des lois de la mécanique - n'est que le premier maillon d'une chaîne de contradictions encore plus aiguës et plus vives en physique.
Ces contradictions conduisent à la nécessité de revoir les fondements de la mécanique du monde atomique. Cette révision est très profonde et conduit à un changement dans notre compréhension de la nature.
La nécessité d'une révision radicale de la mécanique du monde atomique ne signifie pas qu'il faille mettre fin aux lois de la mécanique que nous avons étudiées. Il serait injuste de forcer le lecteur à apprendre des choses inutiles. La mécanique ancienne est pleinement valable dans le monde des gros corps. Cela suffit déjà pour traiter avec le plus grand respect les chapitres correspondants de la physique. Cependant, il est également important qu'un certain nombre de lois de la "vieille" mécanique se transforment en "nouvelle" mécanique. Ceci inclut notamment la loi de conservation de l'énergie.
La présence d'énergie «non inévitable» à un zéro absolu n'est pas une propriété particulière de l'hélium. Il s'avère; L'énergie "zéro" est présente dans toutes les substances.
Seulement dans l'hélium, cette énergie est suffisante pour empêcher les atomes de former un réseau cristallin régulier.
Il n'est pas nécessaire de penser que l'hélium ne peut pas être à l'état cristallin. Pour la cristallisation de l'hélium, il suffit d'augmenter la pression à environ 25 atm. Le refroidissement effectué à une pression plus élevée entraînera la formation d'hélium cristallin solide aux propriétés tout à fait ordinaires. L'hélium forme un réseau cubique centré sur la face.
Sur la fig. La figure 4.14 montre un diagramme d'état de l'hélium. Il se distingue nettement des diagrammes de toutes les autres substances par l’absence de point triple. Les courbes de fusion et d'ébullition ne se croisent pas.

Fig. 4.14
Une autre caractéristique unique est ce diagramme d’état unique: il existe deux fluides à l’hélium différents: quelle différence? Vous le saurez un peu plus tard.
La vaporisation peut se produire non seulement à la suite de l'évaporation, mais également pendant l'ébullition. Pensez à faire bouillir d'un point de vue énergétique.
Une certaine quantité d'air est toujours dissoute dans le liquide. Lorsque le liquide est chauffé, la quantité de gaz dissous dans celui-ci diminue, ce qui libère une partie de celui-ci sous forme de petites bulles au fond et sur les parois du récipient, ainsi que sur les particules solides non dissoutes en suspension dans le liquide. L'évaporation du liquide se produit à l'intérieur de ces bulles d'air. Au fil du temps, les paires en eux deviennent saturées. Avec un chauffage supplémentaire, la pression de vapeur saturée à l'intérieur des bulles et leur volume augmentent. Lorsque la pression de vapeur à l'intérieur des bulles devient atmosphérique, celles-ci remontent à la surface du liquide sous l'action de la force de flottabilité d'Archimède, éclatent et la vapeur les quitte. La vaporisation qui se produit simultanément à partir de la surface du liquide et à l'intérieur du liquide en bulles d'air est appelée ébullition. La température à laquelle la pression de vapeur saturée dans les bulles devient égale à la pression externe est appelée point d'ébullition.
Comme à la même température les pressions des vapeurs saturées de différents liquides sont différentes, à différentes températures, elles deviennent égales à la pression atmosphérique. Cela conduit au fait que différents liquides bouillent à différentes températures. Cette propriété des liquides est utilisée dans la sublimation des produits pétroliers. Lors du chauffage au mazout, ce sont les parties les plus précieuses et les plus volatiles (essence) qui s'évaporent, qui sont ainsi séparées des résidus "lourds" (huiles, fioul).
Du fait que l'ébullition se produit lorsque la pression de vapeur saturée est égale à la pression externe sur le liquide, il s'ensuit que le point d'ébullition du liquide dépend de la pression externe. Si on l'augmente, le liquide bout à une température plus élevée, car pour atteindre cette pression, les vapeurs saturées nécessitent une température plus élevée. Inversement, sous pression réduite, le liquide bout à une température plus basse. Cela peut être vu de l'expérience. Nous chauffons l'eau du ballon jusqu'à ébullition et retirons la lampe à alcool (Fig. 37, a). L'eau bouillante s'arrête. Après avoir fermé le ballon avec un bouchon, nous commencerons par éliminer la vapeur d’air et d’eau par une pompe, ce qui réduira la pression sur l’eau, ce qui entraînera une ébullition. L'ébullition s'arrête à la pression 1 atm l'eau bout à 100 ° C et à 10 atm - à 180 ° C. Cette dépendance est utilisée par exemple dans les autoclaves, dans les médicaments pour la stérilisation, dans la cuisine pour accélérer la cuisson des produits alimentaires.
Pour que le liquide commence à bouillir, il doit être chauffé au point d'ébullition. Pour ce faire, vous devez communiquer de l’énergie au liquide, par exemple la quantité de chaleur Q \u003d cm (t ° à - t ° 0). Lors de l'ébullition, la température du liquide reste constante. En effet, la quantité de chaleur signalée lors de l’ébullition ne sert pas à augmenter l’énergie cinétique des molécules liquides, mais au travail de rupture des liaisons moléculaires, c’est-à-dire à la vaporisation. Lors de la condensation de la vapeur, conformément à la loi de la conservation de l'énergie, elle libère dans l'environnement une quantité de chaleur dépensée pour la vaporisation. La condensation se produit au point d'ébullition, qui reste constant pendant le processus de condensation. (Expliquez pourquoi).
Élaborons l’équation du bilan thermique pour la vaporisation et la condensation. La vapeur prélevée au point d’ébullition du liquide passe par le A. tube vers l’eau du calorimètre (Fig. 38, a) et se condense en ce dernier, ce qui lui donne la quantité de chaleur dépensée lors de sa production. L'eau et le calorimètre reçoivent dans ce cas la quantité de chaleur non seulement de la condensation de la vapeur, mais également du liquide qui en résulte. Les données des grandeurs physiques sont données dans le tableau. 3

La vapeur de condensation dégage de la chaleur Q p \u003d rm 3 (Fig. 38, b). Le liquide obtenu à partir de vapeur, ayant refroidi de t ° 3 à θ °, a perdu la quantité de chaleur Q 3 \u003d c 2 m 3 (t 3 ° - θ °).

Le calorimètre et l’eau, chauffant de t ° 2 à θ ° (Fig. 38, c), recevaient la quantité de chaleur
Q 1 \u003d c 1 m 1 (θ ° - t ° 2); Q 2 \u003d c 2 m 2 (θ ° - t ° 2).
Basé sur la loi de conservation et de conversion de l'énergie
Q p + Q 3 \u003d Q 1 + Q 2,
Ébullition - c'est la vaporisation qui se produit simultanément à la surface et dans tout le volume du liquide. Cela consiste en ce que de nombreuses bulles flottent et éclatent, provoquant un bouillonnement caractéristique.
Comme le montre l'expérience, l'ébullition d'un liquide à une pression externe donnée commence à une température bien définie qui ne change pas pendant le processus d'ébullition et ne peut se produire que lorsque de l'énergie est fournie de l'extérieur par transfert de chaleur (Fig. 1):
où L est la chaleur spécifique de vaporisation au point d'ébullition.

Mécanisme d'ébullition: dans un liquide, il y a toujours un gaz dissous dont le degré de dissolution diminue avec l'augmentation de la température. De plus, il y a du gaz adsorbé sur les parois du navire. Lorsque le liquide est chauffé par le bas (Fig. 2), le gaz commence à être libéré sous forme de bulles près des parois du récipient. L'évaporation du liquide se produit dans ces bulles. Par conséquent, en plus de l'air, il y a de la vapeur saturée en eux, dont la pression augmente rapidement avec la température et les bulles grossissent, et par conséquent, les forces d'Archimède qui agissent sur elles augmentent. Lorsque la force de flottabilité devient supérieure à la gravité de la bulle, elle commence à flotter. Mais jusqu'à ce que le liquide soit uniformément réchauffé, au fur et à mesure que la bulle monte, le volume de la bulle diminue (la pression de vapeur saturée diminue lorsque la température diminue) et, n'atteignant pas la surface libre, les bulles disparaissent (effondrement) (Fig. 2a). C'est pourquoi nous entendons un bruit caractéristique avant bouillante. Lorsque la température du liquide devient égale, le volume de la bulle augmente à mesure qu'il monte, car la pression de vapeur saturée ne change pas et la pression externe sur la bulle, qui est la somme de la pression hydrostatique du liquide au-dessus de la bulle et atmosphérique, diminue. La bulle atteint la surface libre du liquide, éclate et de la vapeur saturée en sort (Fig. 2, b) - le liquide bout. La pression de vapeur saturée dans les bulles est presque égale à la pression externe.

La température à laquelle la pression d'une vapeur saturée d'un liquide est égale à la pression externe sur sa surface libre est appelée point d'ébullition les liquides.
Étant donné que la pression de la vapeur saturée augmente avec l'augmentation de la température, elle doit être égale à la température externe pendant l'ébullition, puis à la hausse avec la pression externe, la température d'ébullition augmente.
Le point d'ébullition dépend également de la présence d'impuretés, augmentant généralement avec la concentration croissante d'impuretés.
Si le liquide est préalablement débarrassé du gaz qui y est dissous, il peut être surchauffé, c.-à-d. chaleur au dessus du point d'ébullition. C'est un état liquide instable. Il y a suffisamment de petits shakes et le liquide bout, et sa température tombe immédiatement au point d'ébullition.
L'ébullition est le processus de modification de l'état d'agrégation d'une substance. Lorsque nous parlons d’eau, nous entendons un changement d’état liquide en vapeur. Il est important de noter que l'ébullition n'est pas une évaporation, qui peut se produire même à température ambiante. Aussi, ne confondez pas avec l'ébullition, qui est le processus de chauffage de l'eau à une certaine température. Maintenant que nous avons compris les concepts, nous pouvons déterminer à quelle température l’eau bout.
Le processus
Le processus de conversion de l'état d'agrégation liquide en gazeux est complexe. Et bien que les gens ne voient pas cela, il y a 4 étapes:
- Au premier stade, de petites bulles se forment au fond du récipient chauffé. Ils peuvent également être vus sur les côtés ou à la surface de l'eau. Ils se forment en raison de la dilatation des bulles d'air, qui se trouvent toujours dans les fissures du réservoir, où l'eau est chauffée.
- Dans la deuxième étape, le volume des bulles augmente. Tous commencent à se déchirer à la surface, car à l'intérieur, il y a de la vapeur saturée, qui est plus légère que l'eau. Lorsque la température de chauffage augmente, la pression des bulles augmente et elles sont poussées vers la surface en raison de la force connue d'Archimède. Dans ce cas, vous pouvez entendre le son caractéristique de l'ébullition, qui se forme en raison de l'expansion constante et de la diminution de la taille des bulles.
- Dans la troisième étape, on peut voir un grand nombre de bulles à la surface. Cela crée initialement une turbidité de l'eau. Ce processus est communément appelé "ébullition avec une touche blanche" et dure une courte période.
- Au quatrième stade, l'eau bout très fort, de grosses bulles éclatantes apparaissent à la surface et des éclaboussures peuvent se produire. Le plus souvent, la pulvérisation signifie que le liquide s'est réchauffé à une température maximale. La vapeur commencera à sortir de l'eau.
On sait que l’eau bout à une température de 100 degrés, ce qui n’est possible qu’au quatrième stade.
Température de la vapeur
La vapeur est l'un des états de l'eau. Lorsqu'il pénètre dans l'air, il exerce, comme les autres gaz, une certaine pression. Pendant la vaporisation, la température de la vapeur et de l'eau reste constante jusqu'à ce que tout le liquide ait changé d'état d'agrégation. Ce phénomène peut s’expliquer par le fait qu’au cours de l’ébullition, toute l’énergie est dépensée pour la conversion de l’eau en vapeur.

Au tout début de l'ébullition, il se forme une vapeur saturée humide qui, après évaporation de tout le liquide, devient sèche. Si sa température commence à dépasser la température de l'eau, cette vapeur est surchauffée et, dans ses caractéristiques, sera plus proche du gaz.
Eau de mer bouillante
Il est assez intéressant de savoir à quelle température bouille une eau à haute teneur en sel. On sait qu'il devrait être plus élevé en raison de la teneur en ions Na + et Cl- dans la composition, qui occupent la région située entre les molécules d'eau. Cette composition chimique de l'eau avec du sel diffère du liquide frais ordinaire.
Le fait est que dans l'eau de mer, il y a une réaction d'hydratation - le processus d'addition de molécules d'eau aux ions de sel. La connexion entre les molécules d'eau douce est plus faible que celles qui se forment lors de l'hydratation, de sorte que l'ébullition d'un liquide avec un sel dissous prend plus de temps. Lorsque la température augmente, les molécules dans l'eau contenant du sel se déplacent plus rapidement, mais elles deviennent plus petites. C'est pourquoi les collisions entre elles se produisent moins souvent. En conséquence, moins de vapeur est formée et sa pression est donc inférieure à celle de la vapeur d'eau douce. Par conséquent, pour une vaporisation complète, il faudra plus d’énergie (température). En moyenne, pour faire bouillir un litre d’eau contenant 60 grammes de sel, il est nécessaire d’augmenter le degré d’eau bouillante de 10% (soit 10 ° C).

Dépend de la pression d'ébullition
On sait qu'en montagne, quelle que soit la composition chimique de l'eau, le point d'ébullition sera plus bas. Cela est dû à la pression atmosphérique inférieure. Une pression de 101,325 kPa est considérée comme normale. Avec cela, le point d'ébullition de l'eau est de 100 degrés Celsius. Mais si vous escaladez une montagne où la pression moyenne est de 40 kPa, l'eau bouillira à 75,88 ° C. Cela ne signifie toutefois pas que vous devrez passer presque la moitié du temps nécessaire pour cuire des aliments dans les montagnes. Pour le traitement thermique des produits, vous avez besoin d'une certaine température.
On pense qu'à une altitude de 500 mètres au dessus du niveau de la mer, l'eau bouillira à 98,3 ° C et qu'à une altitude de 3 000 mètres, la température d'ébullition sera de 90 ° C.
Notez que cette loi s'applique également dans la direction opposée. Si vous placez le liquide dans un ballon fermé à travers lequel la vapeur ne peut pas passer, la pression dans ce ballon augmentera avec l'augmentation de la température et la formation de vapeur, et une ébullition à haute pression se produira à une température plus élevée. Par exemple, à une pression de 490,3 kPa, le point d'ébullition de l'eau sera de 151 ° C.

Eau distillée en ébullition
Distillée est appelée eau purifiée sans aucune impureté. Il est souvent utilisé à des fins médicales ou techniques. Étant donné qu’il n’ya pas d’impureté dans cette eau, elle n’est pas utilisée pour la cuisson. Il est intéressant de noter que l’eau distillée bout plus vite que l’eau douce ordinaire, mais le point d’ébullition reste le même - 100 degrés. Cependant, la différence de temps d'ébullition sera minime - seulement une fraction de seconde.

Dans la bouilloire
Les gens s'intéressent souvent à la température à laquelle l'eau de la théière bout, car ce sont ces appareils qu'ils utilisent pour faire bouillir des liquides. Étant donné que la pression atmosphérique dans l'appartement est égale à la norme et que l'eau utilisée ne contient pas de sels ni d'autres impuretés qui ne devraient pas être là, le point d'ébullition sera également standard - 100 degrés. Mais si l'eau contient du sel, le point d'ébullition, comme nous le savons déjà, sera plus élevé.
Conclusion
Vous savez maintenant à quelle température l'eau bout et comment la pression atmosphérique et la composition du liquide affectent ce processus. Ce n'est pas compliqué et les enfants reçoivent cette information à l'école. L'essentiel est de se rappeler qu'avec une diminution de pression, le point d'ébullition du liquide diminue également et, avec son augmentation, il augmente également.
Sur Internet, vous trouverez de nombreux tableaux indiquant la dépendance du point d'ébullition d'un liquide à la pression atmosphérique. Ils sont accessibles à tous et sont activement utilisés par les écoliers, les étudiants et même les enseignants des instituts.
Tout le monde sait que le point d'ébullition de l'eau à la pression atmosphérique normale (environ 760 mm de mercure) est de 100 ° C. Mais tout le monde ne sait pas que l'eau peut bouillir à différentes températures. Le point d'ébullition dépend d'un certain nombre de facteurs. Si certaines conditions fonctionnent, l'eau peut bouillir à la fois à +70 ° C et à +130 ° C, et même à 300 ° C! Considérez les raisons plus en détail.
De quoi dépend le point d'ébullition de l'eau?
L'eau bouillante dans un récipient se produit selon un certain mécanisme. Lors du chauffage du liquide, des bulles d'air apparaissent sur les parois du récipient dans lequel il est versé. À l'intérieur de chaque bulle, il y a de la vapeur. La température de la vapeur dans les bulles est initialement beaucoup plus élevée que celle de l’eau chauffée. Mais sa pression pendant cette période est supérieure à celle à l'intérieur des bulles. Jusqu'à ce que l'eau se réchauffe, la vapeur dans les bulles est comprimée. Puis, sous l'influence de la pression externe, les bulles éclatent. Le processus dure jusqu'à ce que les températures du liquide et de la vapeur dans les bulles soient égales. C'est maintenant que les boules de vapeur peuvent remonter à la surface. L'eau commence à bouillir. En outre, le processus de chauffage cesse, car la chaleur en excès est éliminée par la vapeur vers l'extérieur dans l'atmosphère. C'est un équilibre thermodynamique. Physique de rappel: la pression de l'eau comprend le poids du liquide lui-même et la pression de l'air au-dessus du récipient avec de l'eau. Ainsi, en modifiant l'un des deux paramètres (pression du liquide dans la cuve et pression atmosphérique), il est possible de modifier la température d'ébullition.

Quel est le point d'ébullition de l'eau dans les montagnes?
En montagne, le point d'ébullition d'un liquide diminue progressivement. Cela est dû au fait que la pression atmosphérique diminue progressivement lors de l'ascension d'une montagne. Pour que l'eau puisse bouillir, la pression dans les bulles apparaissant lors du chauffage de l'eau doit être égale à la pression atmosphérique. Par conséquent, avec une augmentation de l'altitude dans les montagnes tous les 300 m, le point d'ébullition de l'eau diminue d'environ un degré. Une telle eau bouillante n’est pas aussi chaude que le liquide bouillant dans les basses terres. À haute altitude, il est difficile, voire impossible, de préparer du thé. La dépendance à la pression de l'eau bouillante ressemble à ceci:
Altitude | ||||||||
Point d'ébullition |
Et dans d'autres conditions?
Et quel est le point d'ébullition de l'eau dans le vide? Le vide est un milieu raréfié dans lequel la pression est beaucoup plus basse que la pression atmosphérique. Le point d'ébullition de l'eau dans un milieu raréfié dépend également de la pression résiduelle. À une pression dans le vide de 0,001 atm. le liquide bout à 6,7 ° C En général, la pression résiduelle est d'environ 0,004 atm. Par conséquent, à cette pression, l'eau bout à 30 ° C. Avec une pression croissante dans un milieu raréfié, le point d'ébullition du liquide augmentera.

Pourquoi l'eau bouillit-elle dans un récipient scellé à une température plus élevée?
Dans un récipient hermétiquement clos, le point d'ébullition du liquide est lié à la pression à l'intérieur du récipient. En cours de chauffage, de la vapeur se dégage qui se dépose avec le condensat sur le couvercle et les parois du récipient. Ainsi, la pression à l'intérieur du vaisseau augmente. Par exemple, dans un autocuiseur, la pression atteint 1,04 atm. Par conséquent, le liquide bout à 120 ° C. Typiquement, dans de tels conteneurs, la pression peut être ajustée à l'aide des vannes intégrées, donc aussi la température.