Глюконеогенез реакции формулы. Глюконеогенез
Глюконеогенез
Глюконеогенез - синтез глюкозы из неуглеводных предшественников. Глюконеогенез необходим в мозге, яичках, эритроцитах и мозговом веществе почек, где глюкоза является единственным источником энергии. Однако, во время голодания мозг может получать энергию из кетоновых тел, которые превращаются в ацетилКоА.
Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата (ЩУК).
Пируваткарбоксилаза находится в митохондриях. Мембрана митохондрий непроницаема для образовавшегося ЩУКа. Последний здесь же в митохондриях восстанавливается в малат.
Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН2/НАД+ относительно высоко, и поэтому внутримитохондриальный ЩУК легко восстанавливается в малат, который легко выходит из митохондрии, проходя мембрану митохондрий. В цитоплазме же отношение НАДН2/НАД+ очень мало, и малат вновь окисляется в ЩУК при участии НАД-зависимой цитоплазматической малатдегидрогеназы.
Субстраты глюконеогенеза
Лактат - образуется в процессе анаэробного гликолиза в эритроцитах и клетках скелетных мышц. Превращение лактата в глюкозу происходитв результате работы цикла Кори. Значение - с участием цикла Кори конечные продукты гликолиза из эритроцитов и скелетных мышц транспортируется в печень и используются на синтез глюкозы.
Аланин - основная глюкогенная аминокислота. Превращение аланина в глюкозу происходит в аланиновом цикле. В скелетных мышцах пируват, образующий в ходе гликолиза, может превращаться в аланин. Аланин, образующийся в этих реакциях, является транспортной формой NH2-групп из мышц в печень, где они в конечном счёте включаются в молекулы мочевины и экскретируются. При поступлении аланина в гепатоциты он может превращаться в пируват и использоваться как субстрат в глюконеогенезе. Значение - Аммиак является чрезвычайно токсическим соединением и основное его количество обезвреживается в клетках печени (в орнитиновом цикле происходит связывание его в молекулу мочевины и затем экскреция). Аланин служит транспортной формой аммиака в печень, где осуществляется его обезвреживание.
Другие аминокислоты. Только две аминокислоты (лейцин и лизин) не могут использоваться в процессе глюконеогенеза. Это строго кетогенные аминокислоты. Все остальные глюкогенные аминокислоты при своём метаболизме дают промежуточные продукты гликолиза или цикла Кребса.
Глицерол. Образуется при катаболизме триацилглицеролов в клетках жировой ткани, выходит в кровь и затем попадает в печень, где под действием двух ферментов (глицеролкиназа и альфа-глицеролфосфатдегидрогеназа) превращается в фосфодиоксиацетон (ФДА), промежуточный продукт гликолиза.
Пропионил-КоА. Бетта-окисление ЖК с нечётным числом атомов углерода и метаболизм некоторых аминокислот (валин, изолейцин, триптофан, метионин) сопровождается образованием пропионил-КоА, который может быть превращён в сукцинил-КоА (метаболит цикла Кребса) под действием двух ферментов:
Пропионил-КоА-карбоксилаза (в качестве кофермента используется биотин - смотри витамин Н).
Метилмалонил-КоА-мутаза (метилкобаламин в качестве кофермента - смотри витамин В12).
Суммарное уравнение:
2ПВК + 4АТФ + 2ГТФ + 2НАДН + 2Н+ + 6Н2О = глюкоза + 4АДФ + 2ГДФ + 6Ф + 2НАД+
На синтез молекулы глюкозы из двух молекул пирувата расходуется 4АТФ и 2ГТФ. Процесс окисления ЖК поставляет энергию для глюконеогенеза. Для восстановительных этапов требуется две молекулы НАДН.
Пируваткарбоксилаза, катализирующая первую реакцию, имеет аллостерического активатора - ацетилКоА.
Регуляция глюконеогенеза
1).Репрессируется после приёма богатой углеводами пищи (под действием инсулина) и индуцируется при голодании, стрессе, диабете (под действием глюкокортикоидов).
2).Процесс окисления ЖК стимулирует глюконеогенез. Стимуляция осуществляется через увеличение уровня ацетил-КоА.
3).Реципрокная взаимосвязь:
АцетилКоА ингибирует пируватДГ и активирует пируваткарбоксилазу.
АТФ активирует фруктозодифосфатазу, АМФ - ингибирует.
Фруктозо-2,6-дифосфат активирует фосфофруктокиназу-1 и ингибирует фруктозодифосфатазу-1.
Биологическая роль глюконеогенеза.
1. Обеспечение постоянства концентрации глюкозы в крови при углеводном голодании.
2. Перераспределение метаболической нагрузки между органами. Печень берет часть нагрузки мышц.
Между гликолизом, интенсивно протекающим в мышечной ткани при ее активной деятельности, и глюконеогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани. Данный цикл в обмене углеводов получил название цикла Кори (глюкозо-лактатный цикл).
Между гликолизом, интенсивно протекающим в мышечной ткани при ее активной
7. Химизм реакций цикла трикарбоновых кислот. Необратимые реакции цикла. Субстратное фосфорилирование в ходе цикла. Регуляция цикла .
ЦТК можно рассматривать как выработанный клеткой механизм, имеющий двоякое назначение. Основная функция его заключается в том, что это совершенный клеточный "котел", в котором осуществляется полное окисление вовлекаемого в него органического субстрата и отщепление водорода. Другая функция цикла - снабжение клетки рядом предшественников для биосинтетических процессов. Обычно ЦТК является дальнейшей "надстройкой" над анаэробными энергетическими механизмами клетки. Исходным субстратом ЦТК служит ацетил-КоA ("активированная уксусная кислота"), образующийся у аэробов из пирувата в реакции, осуществляемой пируватдегидрогеназным комплексом:
СН3-СО-СООН + КоA-SH + НАД+ переходит в
СН3-СО~S-КоA + НАД*Н2 + СО2
Собственно ЦТК (рис. 92) начинается с конденсации ацетил-КоA с молекулой щавелевоуксусной кислоты, катализируемой цитратсинтазой. Продуктами реакции являются лимонная кислота и свободный кофермент A . Лимонная кислота с помощью фермента аконитазы последовательно превращается в цис-аконитовую и изолимонную кислоты. Последняя превращается в альфа-кетоглутаровую кислоту в реакции, катализируемой изоцитратдегидрогеназой. На первом этапе реакции имеет место дегидрирование изолимонной кислоты, в результате которого образуется щавелевоянтарная кислота и НАД*Н2 . На втором этапе щавелевоянтарная кислота, все еще, вероятно, связанная с ферментом, подвергается декарбоксилированию. Продукты реакции - альфа-кетоглутаровая кислота, освобождающаяся от фермента, и СО2.
альфа-Кетоглутаровая кислота подвергается далее окислительному декарбоксилированию, катализируемому альфа-кетоглутаратдегидрогеназным комплексом, в результате чего образуется сукцинил-КоA . Эта реакция - единственная необратимая реакция из десяти составляющих ЦТК. Один из продуктов реакции - сукцинил-КоA - представляет собой соединение, содержащее высокоэнергетическую тиоэфирную связь.
Следующий этап - образование янтарной кислоты из сукцинил-КоA, катализируемое сукцинилтиокиназой, в результате которого энергия, освобождающаяся при разрыве тиоэфирной связи, запасается в фосфатной связи ГТФ. ГТФ затем отдает свою фосфатную группу молекуле АДФ, что приводит к образованию АТФ. Следовательно, на данном этапе ЦТК имеет место субстратное фосфорилирование.
Янтарная кислота окисляется в фумаровую с помощью фермента сукцинатдегидрогеназы. Далее фумаровая кислота гидратируется под действием фумаразы, в результате чего возникает яблочная кислота, которая подвергается дегидрированию, приводящему к образованию ЩУК. Реакция катализируется НАД-зависимой малатдегидрогеназой. Этой реакцией завершается ЦТК, так как вновь регенерируется молекула-акцептор (ЩУК), запускающая следующий оборот цикла. Однако поскольку из цикла происходит постоянный отток для биосинтезов промежуточных метаболитов, приводящий к понижению уровня ЩУК, возникает необходимость в ее дополнительном синтезе. Это обеспечивается как в реакциях карбоксилирования пирувата или фосфоенолпирувата (табл. 24), так и с помощью последовательности из двух реакций, получивших название глиоксилатного шунта (рис. 92). В первой из них изолимонная кислота под действием изоцитратлиазы расщепляется на янтарную и глиоксиловую кислоты. Во второй реакции, катализируемой малатсинтетазой, глиоксиловая кислота конденсируется с ацетил-КоA с образованием яблочной кислоты, превращающейся далее в ЩУК. В результате двух новых реакций происходит синтез С4-кислоты из двух С2- остатков. Глиоксилатный шунт не работает при выращивании на субстратах, катаболизирование которых приводит к образованию пировиноградной кислоты. Он включается при выращивании организмов на С2- соединениях.
Энергетическим "топливом", перерабатываемым в ЦТК, служат не только углеводы, но и жирные кислоты (после предварительной деградации до ацетил-КоA), а также многие аминокислоты (после удаления аминогруппы в реакциях дезаминирования или переаминирования). В результате одного оборота цикла происходят 2 декарбоксилирования, 4 дегидрирования и 1 фосфорилирование. Итогом 2 декарбоксилирований является выведение из цикла 2 атомов углерода (2 молекулы СО2), т.е. ровно столько, сколько его поступило в виде ацетильной группы. В результате 4 дегидрирований образуются 3 молекулы НАД*Н2 и 1 молекула ФАД*Н2 . Как можно видеть, в процессе описанных выше превращений весь водород оказывается на определенных переносчиках и задача теперь - передать его через другие переносчики на молекулярный кислород.
Как представлено это у эубактерий? С определенными последовательностями ферментативных реакций, аналогичных тем, которые имеют место в ЦТК, мы встречаемся у эубактерий, находящихся на разных этапах эволюционного развития. Некоторые реакции цикла функционируют в анаэробных условиях у бактерий, получающих энергию в процессах брожения.
У пропионовых бактерий в последовательность реакций брожения, ведущих к синтезу пропионовой кислоты, "вмонтированые" реакции от янтарной кислоты до ЩУК, аналогичные таковым ЦТК, но идущие в противоположном направлении и связанные на двух этапах с восстановлением субстратов реакций (рис. 54). В пропионовокислом брожении эти реакции функционируют для акцептирования водорода, являясь одним из вариантов решения донор-акцепторной проблемы в анаэробных условиях.
У других эубактерий мы встречаемся с более полно сформированной последовательностью реакций, аналогичных ЦТК, но еще не замкнутых в полный цикл. Наиболее часто отсутствует ферментативный этап превращения альфа-кетоглутаровой кислоты в янтарную, в результате чего ЦТК представляется как бы "разорванным" (рис. 85). "Разорванный" ЦТК обнаружен у бактерий, осуществляющих бескислородный фотосинтез, цианобактерий, хемоавтотрофов и у некоторых хемогетеротрофов. Вероятно, в таком виде ЦТК не может функционировать в системе энергодающих механизмов клетки. В этом случае его основная функция - биосинтетическая. Тот факт, что "разорванный" ЦТК встречается у различных далеко отстоящих друг от друга физиологических групп эубактерий, указывает на сложные пути эволюции данного механизма. Этот вопрос требует своего объяснения.
Регуляция цикла
Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится (принцип Гульдберга-Вааге). Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалоацетат (субстрат Цикла Кребса) + АДФ + Фн.
16.2.1. Глюконеогенез - биосинтез глюкозы из различных соединений неуглеводной природы. Биологическая роль глюконеогенеза заключается в поддержании постоянного уровня глюкозы в крови, что необходимо для нормального энергообеспечения тканей, для которых характерна непрерывная потребность в углеводах. Особенно это касается центральной нервной системы.
Роль глюконеогенеза возрастает при недостаточном поступлении углеводов с пищей. Так, в организме голодающего человека может синтезироваться до 200 г глюкозы в сутки. Глюконеогенез быстрее, чем другие метаболические процессы, реагирует на изменения диеты: введение с пищей большого количества белков и жиров активизирует процессы глюконеогенеза; избыток углеводов, наоборот, тормозит новообразование глюкозы.
Интенсивные физические нагрузки сопровождаются быстрым истощением запасов глюкозы в организме. В этом случае глюконеогенез является основным путём пополнения углеводных ресурсов, предупреждая развитие гипогликемии. Глюконеогенез в организме тесно связан также с процессами обезвреживания аммиака и поддержанием кислотно-основного баланса.
16.2.2. Основным местом биосинтеза глюкозы de novo является печень. Глюконеогенез протекает также в корковом слое почек. Принято считать, что вклад почек в глюконеогенез в физиологических условиях составляет около 10% глюкозы, синтезируемой в организме; при патологических состояниях эта доля может значительно возрастать. Незначительная активность ферментов глюконеогенеза обнаружена в слизистой тонкого кишечника.
16.2.3. Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов:
а) фосфорилирование глюкозы; б) фосфорилирование фруктозо-6-фосфата; в) превращение фосфоенолпирувата в пируват.Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза.
Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них - пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 16.4, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль её заключается также в пополнении фонда оксалоацетата для цикла Кребса.
Все последующие реакции глюконеогенеза протекают в цитоплазме . Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется фосфоенолпируват (рисунок 16.4, реакция 2).
Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо-1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируетсяфруктозодифосфатазой (рисунок 16.4, реакция 3).
Фруктозо-6-фосфат изомеризуется в глюкозо-6-фосфат. Заключительной реакцией глюконеогенеза является гидролиз глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатазы (рисунок 16.4, реакция 4).
Рисунок 16.4. Обходные реакции глюконеогенеза.
16.2.4. Основными источниками глюкозы в глюконеогенезе являются лактат, аминокислоты, глицерол и метаболиты цикла Кребса.
Лактат - конечный продукт анаэробного окисления глюкозы. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции (см. раздел «Гликолиз», рисунок 15.4, реакция 11). При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори (рисунок 16.5).

Рисунок 16.5. Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Глюкогенные аминокислоты , к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину , который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл , подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин - глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол - продукт гидролиза липидов в жировой ткани. Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат - промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
16.2.5. Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ); б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ); в) обращение первого субстратного фосфорилирования - образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6 ) используются 2 молекулы пирувата (С3 ). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет - 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.

Рисунок 16.6. Энергетический баланс биосинтеза глюкозы из лактата.
16.2.6. Регуляция глюконеогенеза. Скорость глюконеогенеза определяется доступностью субстратов - предшественников глюкозы. Увеличение концентрации в крови любого из предшественников глюкозы приводит к стимуляции глюконеогенеза.
Некоторые метаболиты являются аллостерическими эффекторами ферментов глюконеогенеза. Например, ацетил-КоА в повышенных концентрациях аллостерически активирует пируваткарбоксилазу, катализирующую первую реакцию глюконеогенеза. Аденозинмонофосфат, наоборот, оказывает ингибирующее действие на фруктозодифосфатазу, а избыток глюкозы ингибирует глюкозо-6-фосфатазу.
Гормон поджелудочной железы глюкагон, гормоны надпочечников адреналин и кортизол повышают скорость биосинтеза глюкозы в организме, увеличивая активность ключевых ферментов глюконеогенеза либо увеличивая концентрацию этих ферментов в клетках. Гормон поджелудочной железы инсулин способствует снижению скорости глюконеогенеза в организме.
Глюконеогенез – синтез глюкозы из веществ неуглеводной природы, протекающий в основном в печени, и, менее интенсивно, – в корковом веществе почек и слизистой оболочке кишечника.
Функция глюконеогенеза – поддержание уровня глюкозы в крови при длительном голодании и интенсивных физических нагрузках. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов.
Субстраты глюконеогенеза – ПВК, молочная кислота, глицерин, аминокислоты. Их включение в глюконеогенез зависит от физиологического состояния организма.
Большинство реакций глюконеогенеза являются обратными гликолизу. Они катализируются теми же ферментами, что и соответствующие реакции гликолиза.
Три реакции гликолиза (гексокиназная (1), фосфофруктокиназная (3), пируваткиназная (10)) необратимы, и при глюконеогенезе на этих этапах работают другие ферменты.
Синтез глюкозы из ПВК .
1-ый этап – образование фосфоенолпирувата из ПВК.
а) карбоксилирование ПВК под влиянием пируваткарбоксилазы с образованием оксалоацетата в митохондрии:

Пируваткарбоксилаза – митохондриальный фермент, аллостерическим активатором которого является ацетил-KоА. Для оксалоацетата мембрана митохондрий непроницаема, поэтому оксалоацетат в митохондриях превращается в малатпри участии митохондриальной НАД-зависимой малатдегидрогеназы:

Малат выходит из митохондрии через митохондриальную мембрану в цитозоль, где под действием цитоплазматической НАД-зависимой малатдегидрогеназы окисляется в оксалоацетат:

б) в цитозоле клетки протекает декарбоксилирование и фосфорилирование оксалоацетата с образованием фосфоенолпирувата; фермент – фосфоенолпируваткарбоксикиназа:

2-ой этап – превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат.
Фосфоенолпируват в результате обратимых реакций гликолиза превращается во фруктозо-1,6-фосфат. Далее следует необратимая фосфофруктокиназная реакция гликолиза. Глюконеогенез идёт в обход этой реакции:
3-ий этап – образование глюкозы из фруктозо-6-фосфата.
Фруктозо-6-фосфат превращается в глюкозо-6-фосфат, который дефосфолирируется (реакция идёт в обход гексокиназной) под влиянием глюкозо-6-фосфатазы.
Глюконеогенез - синтез глюкозы из соединений неуглеводной природы.
В организме взрослого человека за сутки может синтезироваться до 250 г глюкозы. Глюконеогенез осуществляется главным образом в печени (синтезируетя до 90 % всей глюкозы), в корковом веществе почек и в энтероцитах (совсем незначительно).
Глюконеогенез стимулируется при длительном голодании, при ограничении поступления углеводов с пищей, в период восстановления после мышечной нагрузки, у новорождённых в первые часы после рождения.
Субстраты глюконеогенеза. Истинными субстратами глюконеогенеза являютя пируват, оксалоацетат, фосфодиоксиацетон, которые непосредственно включаются в этот процесс. Все вещества неуглеводной природы, дающие эти метаболиты, являются субстратами глюконеогенеза: лактат→ПВК, метаболиты цикла Кребса→ЩУК, глицерол→фосфодиоксиацетон, пропионил-КоА→метаболиты цикла Кребса→ЩУК, глюкогенные аминокислоты→ПВК или ЩУК. Главный источник субстратов глюконеогенеза - глюкогенные аминокислоты. К глюкогенным аминокислотам относятся все протеиногенные аминокислоты, кроме лейцина и лизина.
Стехиометрия:
2ПВК + 4АТФ + 2ГТФ + 2НАДН.Н+ + 2Н + 6Н2О Глюкоза + 4АДФ + 2ГДФ + 6Фн + 2НАД +
Глюконеогенез протекает, в основном, по тому же пути, что и гликолиз, но в обратном направлении. Для обхода трех ключевых реакций гликолиза используются четыре специфических фермента глюконеогенеза.
Ключевые ферменты и ключевые реакции глюконеогенеза:
1. Пируваткарбоксилаза
2. Фосфоенолпируваткарбоксикиназа
3. Фруктозо-1,6-бисфосфатаза (Фруктозо-1,6-бисфосфат + Н2О и Фруктозо-6-фосфат + ФН)
4. Глюкозо-6-фосфатаза (Глюкозо-6-фосфат + Н2О и Глюкоза + ФН)
Энергетический баланс. На синтез молекулы глюкозы из двух молекул пирувата расходуется 4АТФ и 2ГТФ (6АТФ). Энергию для глюконеогенеза поставляет процесс β-окис- ления жирных кислот.
Регуляция глюконеогенеза. Глюконеогенез стимулируется в условиях гипогликемии при низком уровне инсулина и преобладании его антагонистов (глюкагона, катехоламинов, глюкокортикоидов).
1. Регуляция активности ключевых ферментов:
фруктозо-1,6-бисфосфатаза по аллостерическому механизму активируется АТФ, ингибирутся Фр-1,6-ФФ и АМФ;
пируваткарбоксилаза активируется СН3СО~КоА (аллостерический активатор).
2. Регуляция количества ключевых ферментов: глюкокортикоиды и глюкагон
индуцируют синтез ключевых ферментов, а инсулин - репрессирует.
3. Регуляция количества субстрата: количество субстратов глюконеогенеза увеличивается под действием глюкокортикоидов (катаболическое действие на белки мышечной и лимфоидной ткани, на жировую ткань), а также глюкагона (катаболическое действие на жировую ткань).
Биологическая роль глюконеогенеза:
1. Поддержание уровня глюкозы в крови. При длительном голодании (голодание более суток) глюконеогенез является единственным процессом, поставляющим глюкозу в кровь.
2. Возвращение лактата в метаболический фонд углеводов. Лактат, образующийся в процессе анаэробного окисления глюкозы в эритроцитах и скелетных мышцах, транспортируется кровью в печень и превращается в гепатоцитах в глюкозу. Это так называемый межорганный цикл Кори.
Потребность в глюконеогенезе
- для эритроцитов глюкоза является единственным источником энергии;
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников;
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях - при низком содержании углеводов в пище, голодании, длительной физической работе, то есть когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза.
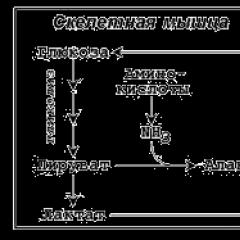
Необходимость глюконеогенеза в организме демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл - это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза . Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата. Убрать молочную кислоту можно только одним способом - превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5 . Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена . Также она может распределиться по другим органам.
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача - уборка лишнего азота из мышцы.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы.
Глюконеогенез энергетически затратен
Все аминокислоты, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них - глюкогенных - полностью включаются в молекулу глюкозы, некоторых - смешанных - частично. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку «шлаков» - лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани.
Обходные пути
Как известно, в гликолизе существуют три необратимые реакции: пируваткиназная (десятая), фосфофруктокиназная (третья) и гексокиназная (первая). В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры, которые клетка обходит с помощью дополнительных реакций.
Глюконеогенез включает все обратимые реакции гликолиза, и особые обходные пути, то есть он не полностью повторяет реакции окисления глюкозы. Его реакции способны идти во всех тканях, кроме последней глюкозо-6-фосфатазной реакции, которая идет только в печени и почках. Поэтому, строго говоря, глюконеогенез идет только в этих двух органах.
Обход десятой реакции гликолиза
На этом этапе глюконеогенеза работают два ключевых фермента - в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа.
В химическом плане обходной путь десятой реакции выглядит достаточно просто:

Упрощенный вариант обхода десятой реакции гликолиза
Однако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа - в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК.
Поэтому в реальности все выглядит более сложно:

Обход десятой реакции гликолиза
- В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминирования аланина. После этого пируват с импортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняющей) реакцией ЦТК.
- Далее оксалоацетат мог бы превратиться в фосфоенолпируват, но для этого сначала он должен попасть в цитозоль. Поэтому происходит реакция восстановления оксалоацетата в малат при участии малатдегидрогеназы. В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из β-окисления жирных кислот, активируемого в условиях недостаточности глюкозы в гепатоците.
- В цитоплазме фосфоенолпируват-карбоксикиназа осуществляет превращение оксалоацетата в фосфоенолпируват, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.