Коллоиды и коллоидные растворы. Коллоидные растворы - новое слово в медицине Коллоиды и их свойства
Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах. Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
I тип - суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей. Первичные частицы дисперсной фазы коллоидных растворов этих веществ по своей внутренней структуре не отличаются от структуры соответствующего компактного вещества и имеют молекулярную или ионную кристаллическую решетку. Суспензоиды - типичные гетерогенные высокодисперсные системы, свойства которых определяются очень сильно развитой межфазной поверхностью. От суспензий они отличаются более высокой дисперсностью. Суспен-зоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности. Необратимыми их называют потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой. Лиофобными (греч. "лиос" - жидкость, «фобио» - ненавижу) их назвали, предполагая, что особые свойства коллоидных растворов этого типа обусловлены очень слабым взаимодействием дисперсной фазы и дисперсионной среды. Концентрация лиофобных золей невелика, обычно меньше . Вязкость таких золей незначительно отличается от вязкости дисперсионной среды.
Лиофобные золи, как вообще дисперсные системы, в соответствии с их промежуточным положением между миром молекул и крупных тел, могут быть получены двумя путями: методами диспергирования, т. е. измельчения крупных тел, и методами конденсации молекулярно - или ионнорастворенных веществ. Измельчение путем дробления, помола, истирания дает сравнительно крупно-дисперсные порошки .
Более тонкого измельчения достигают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применяя ультразвук.
Метод конденсации состоит в получении нерастворимых соединений путем реакций обмена, гидролиза, восстановления, окисления. Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы. К конденсационным методам относится также получение лиозолей путем замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая ее спиртовой раствор в воду, в которой канифоль нерастворима.
Как было выяснено ранее (§ 106), чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности. Поэтому для получения устойчивых, т. е. длительно сохраняющихся, суспензий, эмульсий, коллоидных растворов необходимо не только достигнуть заданной дисперсности, но и создать условия для ее стабилизации. Ввиду этого устойчивые дисперсные системы состоят не менее чем из трех компонентов: дисперсионной среды, дисперсной фазы и третьего компонента - стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу. Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой (см. § 112 и 113).
Высокомолекулярные соединения (белки, полипептиды, спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами. Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы. Структурно-механическая стабилизация имеет решающее значение для стабилизации вззесей, паст, пен, концентрированных эмульсий.
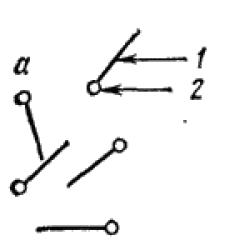
II тип - ассоциативные, или мицелл я рные, коллоиды. Их называют также полуколлоидами. Коллоиднодисперсные частицы этого типа возникают при достаточной концентрация дифильных молекул низкомолекулярных веществ путем их ассоциации в агрегаты молекул - мицеллы - сферической или пластинчатой формы (рис. 90):

Рис. 90. Растворы мицеллярных коллоидов; молекулярный раствор (а), коллоидные раствори со сферическими (б) и пластинчатыми (в) мицеллами. Дифильная молекула: 1 - углеводородный радикал; 2 - полярная группа.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.
Образование мицелл характерно для водных растворов моющих веществ (например, мыл - щелочных солей высших жирных кислот) и некоторых органических красителей с большими молекулами. В других средах, например в этиловом спирте, эти вещества растворяются с образованием молекулярных растворов.
III тип - молекулярные коллоиды. Их называют также обратимыми или лиофильными (от греч. "филио" - люблю) коллоидами. К ним относятся природные и синтетические высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений - это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов. Растворы высокомолекулярных соединений могут быть приготовлены также с высоким содержанием по массе - до десяти и более процентов. Однако молярная концентрация таких растворов мала из-за большой молекулярной массы растворенного вещества. Так, 10 %-ный раствор вещества с молекулярной массой 100 000 представляет собой лишь примерно 0,0011 М раствор.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем. Неполярные макромолекулы растворяются в углеводородах (например, каучуки - в бензоле), а полярные макромолекулы - в полярных растворителях (например, некоторые белки - в воде и водных растворах солей). Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
Название лиофнльные коллоиды возникло из предположения (как оказалось - ошибочного), что сильное взаимодействие со средой обусловливает их отличие от лиофобных коллоидов.
Растворение макромолекулярных коллоидов проходих через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа. При набухании молекулы растворителя проникают в твердый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличении объема полимера. Набухание может быть неограниченным, когда конечным его результатом является переход полимера в раствор, и ограниченным, если набухание не доходит до растворения полимера. Ограниченно набухают обычно полимеры с особой, «трехмерной» структурой, отличающейся тем, что атомы всего вещества соединены валентными связями. Химическая модификация полимеров путем «сшивания» их макромолекул с целью уменьшения набухания полимера является важной стадией в производстве многих материалов (дубление сыромятной кожи, вулканизация каучука при превращении его в резину).
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и часто понижение температуры приводят к застудневанию, т. е. превращению сильно вязкого, но текучего раствора в сохраняющий форму твердообразный студень. Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студии и гели в растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Застудневание является важной стадией получения волокнистых материалов из растворов полимеров. Свойства растворов высокомолекулярных соединений с повышением их концентрации все больше и больше отличаются от свойств растворов низкомолекулярных соединений. Это происходит в результате взаимодействия друг с другом отдельных макромолекул, приводящего к образованию надмолекулярных структур, оказывающих большое влияние на качества изделий (волокон, пластмасс) из полимеров.
Высокомолекулярные соединения, как и любые другие вещества, при подходящих условиях могут быть получены в высокодисперсном - коллоидном состоянии. Такие дисперсии полимеров в нерастворяющих их жидкостях, большей частью в воде, называют латекса . Частицы дисперсной фазы латексов имеют близкую к сферической форму и размеры порядка 10-100 нм.
Термин «коллоиды», что означает «клееподобные» (от греч. «колла» - клей, «еидос» - вид), возник в 1861 г., когда шотландский химик Томас Грэм для разделения веществ применил диализ (рис. 91). Метод диализа основан на неодинаковой способности компонентов растворов к диффузии через тонкие пленки - мембраны (из целлофана, пергамента, нитроцеллюлозы, ацетилцеллюлозы).

Рис. 91. Схема диализа: 1 - внутренний диализируемый раствор; 2 - наружная жидкость; 3 - диализационная мембрана (через ее поры проходят только низкомолекулярные вещества); 4 - шкив для вращения мембраны с внутренним раствором.
Этот метод широко применяют для очистки коллоидных растворов и растворов высокомолекулярных соединений. Вещества, не проникающие через мембраны при диализе, Грэм назвал коллоидами, а вещества, способные к кристаллоидами, так как при выпаривании их растворов образовывались кристаллические осадки.
Деление веществ на кристаллоиды и коллоиды оказалось ошибочным. П. П. Веймарн, доцент Петербургского горного института, получил ряд типичных «кристаллоидов» в коллоидном состоянии, тем самым доказав (1906 г.), что любое вещество при подходящих условиях может быть получено в коллоидном состоянии.
В 30-40-х годах XX века была выяснена химическая природа первичных частиц обратимых (лиофильных) коллоидов, оказавшихся макромолекулами. В связи с этим от коллоидной химии отделилась новая химическая дисциплина - физическая химия высокомолекулярных соединений. Однако в силу исторических причин, общности молекулярно-кинетических свойств лиофильных и коллоидов, частого образования гетерогенных структур в молекулярных коллоидах, а также существования многочисленных композиций из высокомолекулярных соединений и высокоднсперсных систем (например, резины, многие лакокрасочные материалы, стеклопластики, пено- и поропласты) предмет коллоидной химии трактуют более расширенно, чем сказано в § 106, а имеино, как физическую химию гетерогенного дисперсного состояния вещества, межфазовых поверхностей и высокомолекулярных соединений.
В результате изучения материала главы 18 студент должен: знать теоретические основы коллоидной химии: поверхностных явлений, образования и устойчивости дисперсных систем, механизмов и закономерностей процессов, протекающих в этих системах; различные методы определения размеров частиц дисперсной фазы, методы оценивания смачивания твердых поверхностей; кинетические, реологические и электрические свойства дисперсных систем; закономерности адсорбции веществ на границах раздела различной природы; закономерности поверхностных и природных явлений и производственных процессов с их участием;
уметь строить интегральные и дифференциальные кривые распределения частиц; определять угол смачивания; экспериментально определять поверхностное натяжение жидкостей и влияние поверхностно-активных веществ (ПАВ) на эту величину; экспериментально определять величину адсорбции;
владеть методами обработки результатов химических экспериментов в части обработки данных коллоидно-химических экспериментов; основными синтетическими и аналитическими методами получения и исследования веществ, находящихся в коллоидном состоянии.
Коллоидная химия - раздел физической химии, изучающий двух- или многофазные системы, в которых хотя бы одна из фаз находится в высокодисперсном состоянии. Введем основные понятия, которые используются в коллоидной химии.
Основные понятия
Фаза - часть системы одного состава, одинаковых физических и химических свойств, ограниченная от других частей поверхностью раздела. Систему, состоящую из одной фазы, а следовательно, имеющую одинаковые свойства во всех ее точках, называют гомогенной. Гетерогенная система состоит из двух и более фаз. Гетерогенная система, в которой одна из фаз представлена в виде частиц микроскопических размеров, называется микрогетерогенной или улътрамикрогетерогенной. Эти два класса систем являются дисперсными системами. Дисперсными называются системы, состоящие из двух или более фаз, одна из которых состоит из отдельных мелких частиц (дисперсная фаза ), распределенных в другой фазе (дисперсионной среде). Каждая частица состоит из достаточно большого числа молекул.
Коллоидные системы характеризуются предельно высокой дисперсностью, т.e. степенью развития поверхности раздела. При раздроблении (диспергировании) дисперсной фазы, т.е. при возрастании ее дисперсности.
увеличивается внутренняя поверхность раздела между фазами. При этом возрастает роль граничных слоев и связанных с ними особых явлений. Именно особые свойства раздела фаз и изучает коллоидная химия. Иногда коллоидную химию называют химией поверхностных явлений.
Дисперсность (5) представляет собой удельную поверхность дисперсной фазы и определяется соотношением
где S1,2 - площадь поверхности раздела между дисперсной фазой (I) и дисперсионной средой (2); V - объем дисперсной фазы. Таким образом, дисперсность обратно пропорциональна линейным размерам частиц и обладает размерностью см -1 .
Коллоидные системы относятся к дисперсным системам - системам, где одно вещество в виде частиц различной величины распределено в другом. Дисперсные системы чрезвычайно многообразны; практически всякая реальная система является дисперсной. Дисперсные системы классифицируют прежде всего по размеру частиц дисперсной фазы (или степени дисперсности); кроме того, их разделяют на группы, различающиеся по природе и агрегатному состоянию дисперсной фазы и дисперсионной среды.
Коллоидные системы весьма распространены в природе. К ним относятся различные ткани животного и растительного мира, почва.
Если дисперсионной средой является жидкость, а дисперсной фазой - твердые частицы, система называется взвесью или суспензией ; если дисперсная фаза представляет собой капельки жидкости, то систему называют эмульсией. Эмульсии, в свою очередь, подразделяют на два типа: прямые, или "масло в воде" (когда дисперсная фаза - неполярная жидкость, а дисперсионная среда - полярная жидкость) и обратные, или "вода в масле" (когда полярная жидкость диспергирована в неполярной). Среди дисперсных систем выделяют также пены (газ диспергирован в жидкости) и пористые тела (твердая фаза, в которой диспергированы газ либо жидкость). Основные типы дисперсных систем приведены в табл. 18.1.
Таблица 18.1
Основные типы дисперсных систем
К коллоидным системам близки и растворы высокомолекулярных соединений, которые, не являясь коллоидными в прямом смысле этого слова, по многим свойствам близки им. Размеры молекул высокомолекулярных соединений могут даже превышать размеры коллоидных частиц. Водные растворы многих полимеров, например белков, реально являются не однофазными системами, а микрогетерогенными, так как включают гидрофобные области внутри белковых глобул. С другой стороны, в разбавленных растворах высокомолекулярные соединения раздроблены до молекул и, следовательно, эти растворы не могут быть отнесены к типичным коллоидным системам. Растворы высокомолекулярных соединений объединяют свойства и коллоидных систем, и истинных растворов.
Кроме того, любые вещества при определенных условиях могут быть в коллоидном состоянии.
По степени дисперсности выделяют обычно следующие классы дисперсных систем.
Грубодисперсные системы - системы, размер частиц дисперсной фазы в которых превышает 10 -5 м (табл. 18.2).
Таблица 18.2
Классификация дисперсных систем в зависимости от размера частиц дисперсной фазы
Коллоидные системы - системы, размер частиц дисперсной фазы в которых составляет 10~ 7 -10~ 9 м. Коллоидные системы характеризуются гетерогенностью, т.е. наличием поверхностей раздела фаз и очень большим значением удельной поверхности дисперсной фазы. Это обусловливает значительный вклад поверхностной фазы в состояние системы и приводит к появлению у коллоидных систем особых, присущих только им, свойств.
Иногда выделяют молекулярно(ионно)-дисперсные системы , которые, строго говоря, являются истинными растворами, т.е. гомогенными системами, поскольку в них нет поверхностей раздела фаз.
Коллоидные системы, в свою очередь, подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды, - лиофобные коллоидные растворы (золи) и растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами. К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Растворы ВМС образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и растворы ВМС различаются также и структурой частиц, составляющих дисперсную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава - мицелла, для растворов ВМС - макромолекула.
Таким образом, размер частиц (или дисперсность) является одним из важнейших количественных показателей дисперсных систем, определяющих их качественные особенности.
Третий признак, по которому классифицируют все дисперсные системы, обусловлен видом дисперсной фазы. Дисперсную фазу могут составлять частицы, пленки, мембраны, нити или капилляры.
Различают трехмерные (частицы), двухмерные (нити, волокна, капилляры, поры) и одномерные (мембраны, пленки) дисперсные фазы.
Кроме общих признаков, которые охватывают все дисперсные системы, существует ряд частных признаков. Эти признаки характерны только для некоторых дисперсных систем. В основу частной классификации положены:
- 1) способы получения дисперсных систем;
- 2) структурно-механические свойства;
- 3) взаимодействие между дисперсной фазой и дисперсионной средой;
- 4) устойчивость дисперсных систем.
- 1. Классификация по структуре.
Все дисперсные системы можно разделить на два класса - свободно-дисперсные в которых частицы дисперсной фазы не связаны между собой и могут перемещаться свободно (суспензии, эмульсии, золи, в том числе аэрозоли), и связно-дисперсные , в которых одна из фаз не перемещается свободно, поскольку структурно закреплена. К ним относятся капиллярно-пористые тела, мембраны - тонкие пленки, гели, студни, пены - жидкие сетки с воздушными ячейками, твердые растворы.
2. Классификация по межфазному взаимодействию.
Взаимодействие между веществами дисперсной фазы и дисперсионной
среды за счет межмолекулярных сил на границе раздела фаз протекает всегда, но степень его проявления может быть различной.
В зависимости от этого дисперсные системы могут быть лиофильными и лиофобными.
Для первых характерно сильное межмолекулярное взаимодействие вещества дисперсной фазы со средой, а для вторых - слабое. Лиофильные системы термодинамически устойчивы (AG < 0) и характеризуются самопроизвольным диспергированием. Системы, в которых самопроизвольного диспергирования не происходит, могут быть названы лиофобными, но они лиофилизированы в той или иной степени.
Под словом «коллоиды» в настоящее время понимают ультрамикрогетерогенные системы, то есть такие системы, где в так называемой дисперсионной среде взвешены ультрамикроскопические частички, представляющие собой отдельную фазу. Грегем под коллоидами подразумевал вещества, которые, будучи распределены в той или иной жидкости и обнаруживая все внешние признаки обычных растворов, при более детальном изучении резко от последних отличаются.
Он полагал, что различие это кроется в самой природе данного вещества; поэтому он разделил весь вещественный мир на два класса: коллоиды и кристаллоиды. Более поздние исследования показали, однако, что между кристаллоидами и коллоидами не существует какой-либо непреодолимой преграды и что принципиально всякое вещество, дающее в данной жидкости истинный раствор,может образовать в иной жидкости систему со всеми свойствами коллоидов.
Поэтому сейчас правильнее говорить не о коллоидах, а о коллоидном состоянии или о коллоидных системах. Пример: поваренная соль (NaCl) дает в водной среде исключительно истинный раствор, наоборот, будучи распределена в таких жидкостях, как эфир или бензол, не являющихся для нее растворителями, она при известных условиях может дать такие системы, которые по всем своим свойствам и особенностям могут назваться коллоидными системами.
Коллоиды и их особенности
Особенности коллоидных систем, отличающие их, главным образом, от обычных или истинных растворов.
Броуновское движение и связанное с ним осмотическое давление и диффузия. В то время как в истинных растворах частицами, взвешенными в данной жидкости, являются молекулы (раствор сахара в воде), а иногда и ионы (растворы электролитов), частицы коллоидных систем неизмеримо крупнее: они состоят из тысяч, а иногда и из сотен тысяч молекул, соединенных в один плотный комплекс, называемый ядром.
Некоторые коллоидисты полагают, что в природе могут быть вещества с такими крупными молекулами, что эти последние играют роль коллоидных частиц. Этот вопрос пока что приходится считать спорным. При этом не нужно забывать, что сущность дела состоит не в размере молекулы, а в том, чтобы эта молекула могла сыграть роль самостоятельной фазы, т. е. в том, чтобы мы имели основания признать такую систему молекулярной степени дисперсности как микрогетерогенную систему.
Молекулы раствора (или газа), как известно, находятся в непрерывном тепловом хаотическом движении. Такому же движению, хотя в ином, чрезвычайно уменьшенном масштабе, подвержены и частицы коллоидной системы. В силу исторических причин это движение коллоидных частиц носит особое название броуновского движения, однако не нужно забывать, что физическая сущность его совершенно идентична с движением молекулярным.
Разница здесь не качественная, а количественная. То же нужно сказать и о тех свойствах, которые являются непосредственным выражением броуновского движения, а именно - об осмотическом давлении и о диффузии. Осмотическое давление, точно так же, как и газовое, является функцией количества частиц в единице объема или, как принято говорить, функцией частичной концентрации. Такая концентрация в коллоидных системах по сравнению с системами истинно растворенными чрезвычайно мала, а потому и осмотическое давление в них ничтожно. Оно настолько мало, что лишь в самое последнее время удалось найти методы для его количественного определения.
То же самое нужно сказать и о диффузии. Грегем полагал, что диффузия отсутствует у коллоидных систем, и считал это отсутствие диффузии яркой качественной характеристикой коллоидов. Это оказалось неверным и иначе не могло быть, ибо факт существования броуновского или, что то же самое, молекулярного движения частиц логически требовал существования и диффузии. Но этот диффузионный процесс в соответствии с масштабом броуновского движения оказался настолько замедленным, что констатировать его, а тем более измерить количественно удалось лишь в последнее время, использовав все современные технические возможности.
3- перепонка из пергамента
Коллоидные растворы рассматривают особо, потому что их свойства существенно отличаются от свойств истинных растворов и грубодисперсных систем. Примерами коллоидного раствора могут служить растворы белка, клея, желатины и пр.
Отличить коллоидный раствор от истинного можно на следующем опыте. Если взять банку без дна, затянуть отверстие пергаментом, налить в нее раствор поваренной соли и опустить в сосуд с водой (рис. 18), очень скоро в сосуде станет соленой. Если же вместо раствора поваренной соли налить раствор белка, в сосуде с водой белка не обнаружится.Следовательно, коллоидный раствор белка не проникает через полупроницаемую перегородку. Этим свойством пользуются для очистки коллоидного раствора от примеси растворимых солей. Описанный процесс называется диализом и осуществляется в диализа-торах.
Если в темном помещении пропустить через коллоидной раствор узкий пучок света и наблюдать за ним сбоку, в растворе очень хорошо будет заметен путь световых лучей (рис. 19). Если пропускать такой же пучок световых лучей через истинный раствор, то путь света не будет заметен, так как коллоидные частицы достаточно велики, чтобы рассеивать свет, а частицы молекулярных растворов слишком малы для этого. Это явление, характерна для коллоидных растворов, называется явлением Тиндаля.
■ 146. Как отделить коллоидный раствор от истинного?
147. Что такое явление Тиндаля и почему с его помощью можно отличить коллоидный раствор от истинных растворов и взвесей?
Коллоидные частицы, или, как их называют мицеллы, представляют собой либо отдельные крупные молекулы (например, молекулы белка, крахмала, либо группу молекул (например, мицеллы мыла или гидроокисей алюминия, железа).
Следует отметить, что большинство веществ может образовывать как коллоидные, так и истинные растворы в зависимости от растворителя. Например, мыло в воде дает коллоидный раствор, а в спирте истинный.
Мы уже говорили о том, что из суспензий дисперсная фаза может с течением времени выделиться, так как частицы ее достаточно крупные; эмульсии также более или
менее легко расслаиваются. Что касается коллоидных растворов, то они довольно устойчивы и могут храниться годами, но постепенно «стареют» и этим отличаются от истинных растворов, которые могут храниться бесконечно долго. Устойчивость коллоидных частиц объясняется тем, что последние обладают свойством адсорбции.
Рис 19. Явление Тиндаля. 1 - истинный раствор; 2 - коллоидный раствор; 3 - световой конус в коллоидном растворе; 4 - источник света.
Адсорбцией называется процесс концентрации молекул иди ионов из окружающей среды на поверхности частиц , находящегося в этой среде, а само вещество называется адсорбентом.
Запишите определение адсорбции.
Поскольку в растворе всегда имеются ионы, коллоидные частицы адсорбируют их из раствора, причем коллоидные частицы обладают избирательным свойством. Они адсорбируют либо положительные, либо отрицательные ионы. Вокруг заряженных коллоидных частиц группируются ионы с противоположным зарядом - противо-ионы, образующие слой вокруг коллоидной частицы. В свою очередь вокруг противоионов образуется еще одна
оболочка уже из молекул воды. Вся эта сложная система (рис. 20) и носит название мицеллы.
В связи с тем, что коллоидные частицы заряжаются одноименно, это мешает им сталкиваться и укрупняться, чем и объясняется устойчивость коллоидных растворов. Однако изредка это может происходить.Тогда наблюдается постепенное «старение» коллоидных растворов.

Рис. 20. Схема строения мицеллы. 1 - коллоидная частица; 2 - адсорбированные отрицательные ионы; 3 - положительные противоионы.
Для доказательства того, что коллоидные частицы имеют заряд, нужно пропустить через раствор постоянный электрический ток. В этом случае коллоидные частицы будут передвигаться к одному из электродов. Это явление называется электрофорезом. В настоящее время электрофорез находит широкое применение при клинических лабораторных исследованиях белковых фракций.
■ 148. Как образуется мицелла?
149. Почему коллоидные частицы всегда заряжены?
150. Что такое ?
151. Что такое «старение» коллоидных растворов?
152. Что такое электрофорез и где он применяется?
Коллоидов. При нагревании коллоидного раствора, как обычно, происходит увеличение скорости движения коллоидных частиц и ионов. Кроме того, уменьшается , так как происходит обратное явление- десорбция. Вследствие увеличения скорости движения коллоидных частиц и уменьшения их зарядности (от десорбции) увеличивается возможность столкновения коллоидных частиц, их слипания друг с другом и выпадения в осадок. Это процесс укрупнения частиц называется коагуляцией.
Для того чтобы вызвать коагуляцию, проще всего снять заряд с коллоидной частицы, что достигается прибавлением какого-либо электролита к коллоидному раствору. Хотя при этом в раствор вводится одинаковое количество и одноименных зарядов, в непосредственно прилегающей к коллоидной частице ионной сфере увеличивается концентрация противоположно заряженных ионов, которые и нейтрализуют заряд коллоидной частицы. Коллоидные частицы разряжаются, сталкиваются, соединяются в более крупные частицы и коагулируют.
Коллоидное вещество, находящееся в коллоидном растворе, называется золем, а вещество, подвергшееся коагуляции, гелем. Таким образом, процесс перехода золя в гель называется коагуляцией, а обратный переход геля в золь называется пептизацией. Процесс пептизации сопровождается набуханием коллоида, что играет очень большую роль в биологических процессах.
Коллоидов вызывается и различными органическими веществами - спиртом, карболовой кислотой, формалином и т. д. Объясняется она сменой растворителя. Такие , которые вызывают коагуляцию коллоидов, называются, коагулянтами.
Коагулянтом может являться даже другой коллоидный раствор, если заряды их коллоидных частиц противоположны. Например, таким коагулянтом, как гидроокись алюминия Аl(ОН)3, широко пользуются для очистки питьевой воды от коллоидов. В природной воде всегда содержится большое количество коллоидов, которые прекрасно проходят сквозь фильтры и от которых нужно освободиться. Для этого в воду добавляют сульфат алюминия Al2(SО4)3 или квасцы KAl(SО4)2, которые гидролизуются водой, образуя гидроокись алюминия в виде коллоидного раствора с положительным зарядом. Этот коллоидный раствор и осаждает находящиеся в воде отрицательно заряженные коллоидные частицы.
■ 153. Запишите в тетрадь определения десорбции, коагуляции, пептизации, золя, геля, коагулянта.
154. Перечислите причины, которые могут вызвать коагуляцию раствора.
Способы получения коллоидных растворов.
Получить коллоидные растворы можно двумя путями. Первый путь - это путь укрупнения более мелких частиц, так называемый конденсационный путь. Например, чтобы получить рубиновое , нужно приготовить коллоидный раствор золота в стеклянной массе. Для этого в расплавленное добавляют соли золота, которые разлагаются с выделением атомов чистого металла. Атомы золота начинают группироваться в более крупные чаг стицы, а когда они достигнут нужных размеров, охлаждают и укрупнение частиц прекращается.
Второй путь - дисперсионный. При этом происходит дробление крупных частиц на более мелкие. Это осуществляется с помощью коллоидных мельниц или ультразвука.
С коллоидами мы встречаемся повсеместно: любая растительная или животная содержит белок в виде коллоидного раствора. Во многих отраслях промышленности (мыловаренная, маргариновая, фармацевтическая, производство искусственного волокна) специально изготовляются коллоиды. Для многих отраслей коллоиды служат сырьем, например для резиновой, кондитерской, бумажной, текстильной промышленности.
■ 155. Укажите способы получения коллоидных растворов.
Что представляют собой все живые организмы? Мы знаем еще со школы, что человек, например, состоит из разных тканей, костей и т.д. Знаем, что на 80% (на самом деле меньше) он состоит из воды. Так вот, люди - это, фактически, большие ходячие коллоидные растворы. И чтобы знать, как их лучше лечить, надо хорошо понимать, что собой представляют эти вещества. Раздел химии, занимающийся изучением коллоидального жизненного субстрата, сравнительно молод, но в последние годы интерес к нему значительно возрос.
Что такое коллоиды?
Собственно, не совсем правильно говорить о коллоидных веществах. Скорее, речь идет о коллоидальном состоянии вещества. Чем же оно отличается от любого другого? Коллоидные растворы - это те же дисперсные материи, которые отличаются низкой концентрацией в растворе взвешенных частиц (почему возникает и частицы обладают высокой и очень маленькими их размерами. До того маленькими, что их невозможно увидеть в обычный микроскоп. растворов субмикроскопичны. Но это все-таки не растворы в полном смысле, потому что растворами принято считать тоже только на молекулярно-ионном уровне. В то же время, это не суспензии с эмульсиями, характеризующиеся как дисперсные системы с достаточно крупными частицами. Коллоиды занимают промежуточную ступеньку.
Классификация коллоидов
Коллоиды не обязательно должны быть жидкими, они могут находиться и в твердом состоянии. Тогда их называют студнями или гелями. Но, в отличие от не имеют четкой грани между различными агрегатными состояниями, и могут переходить из одного состояния в другое при изменении внешних факторов, например температуры.
Кроме того, в зависимости от дисперсной среды, коллоидные растворы могут быть гидрозолями и гидрогелями, если основой является вода, или алкозолями (если основа - спирт), этерозолями (эфир) и т.д. Дисперсной средой пирозолей является какое-то расплавленное тело, а криозолей - наоборот, низкотемпературное вещество.
Для нас, собственно, важно, что на фармацевтическом рынке стали появляться первые коллоидные растворы, в медицине они способны произвести переворот, так как воздействуют на наш организм на качественно ином уровне.
Основные возможности коллоидной фармацевтики.
Мы уже знаем, что состав всех внутренних органов человеческого организма - это коллоидные растворы. А это значит, взаимодействие двух идентичных по химическим свойствам веществ происходит значительно быстрее и практически без потерь. То есть биологически активные ингредиенты лекарственного препарата на 98% сразу проникают в ткани и органы человека именно благодаря структурному сходству составов.
По этой же причине из коллоидных фитоформул начинают усваиваться уже в полости рта через слизистую. Ведь обычные лекарства наш организм вначале доводит до коллоидного состояния в желудочно-кишечном тракте, а потом усваивает. Тут же ему предлагают уже готовый к использованию раствор. Значит эффект от лекарства наступает незамедлительно.
Усовершенствование достаточно сложных технологий производства коллоидов дало возможность в один раствор вместить совершенно разные ингредиенты, получая высокоэффективные препараты, способные воздействовать на организм комплексно практически без побочных эффектов (ведь печени не нужно ничего перерабатывать, а почкам выводить).
К таким относятся инновационные препараты новосибирской (основанной при академгородке еще 1996 году) компании Арго, коллоидные растворы которой практически уникальны. Уже разработаны фитоформулы АнгиОмега, Анти-Оксидант, АртроКомплекс, Детокс, ГастероКомплекс и другие биологически активные формулы, ценность которых трудно переоценить.