Polimerët biologjikë proteina strukturën dhe funksionin e tyre. Farë është një polimer? I. Struktura e proteinave
Abstrakt i përgatitur
Nxënësi 10 klasa "A"
Pavelchuk Vladislav
PËRMBAJTJAparaqitje
1. Struktura e proteinave.
2. Klasifikimi i proteinave.
3. Organizimi strukturor i molekulave të proteinave.
4. Izolimi i proteinave.
5. Reagimet e ngjyrave të proteinave.
6. deshifrimi i strukturës primare të proteinës.
7. Funksionet e proteinave.
8. Si të sintetizoni proteinën.
9. Përfundimi.
referencat
HYRJE
Proteinat së bashku me acidet nukleike, lipidet, karbohidratet, disa substanca organike me peshë të ulët molekulare, kripëra minerale dhe ujë formojnë protoplazmën e të gjithë organizmave tokësorë - kafshëve dhe bimëve, komplekse dhe elementare. Termi "protoplazëm" u propozua nga fiziologu çek Purkine (1839) për t'iu referuar përmbajtjes së një qelize të gjallë. Përmbajtja e proteinave në protoplazmë, si rregull, është dukshëm më e lartë se të gjithë përbërësit e tjerë të saj (duke mos llogaritur ujë). Në shumicën e rasteve, proteinat përbëjnë deri në 75-80% të masës së thatë të qelizave.
Substancat proteinike paraqesin pjesën kryesore, më aktive të protoplazmës: "Karakteristikat e atij komponenti, i cili është i pranishëm në një sasi më të madhe dhe që është më aktive, shkëlqejnë përmes protoplazmës më qartë" A. Danilevsky (substanca kryesore e protoplazmës dhe modifikimi i tij nga jeta. 1894).
Besimi për rëndësinë e shkallës së parë të proteinave për jetën mbetet i palëkundur edhe në kohën tonë, megjithë zbulimin e rolit të acideve nukleike në fenomenet e trashëgimisë, sqarimin e rëndësisë jetike për vitaminat, hormonet, etj.
Për shkak të karakteristikave të përbërjes dhe strukturës së tyre, proteinat shfaqin një larmi të jashtëzakonshme të vetive fizike dhe kimike. Proteinat që janë plotësisht të tretshme në ujë janë të njohura, ka proteina që janë jashtëzakonisht të paqëndrueshme, duke ndryshuar nën ndikimin e dritës së dukshme ose edhe një prekje të lehtë mekanike. Ka proteina, molekulat e të cilave duken si filamente që arrijnë një gjatësi prej disa milimetra, dhe ka proteina, molekulat e të cilave janë topa me dhjetëra kënde në diametër. Por në të gjitha rastet, struktura dhe vetitë e proteinave janë në një lidhje të ngushtë dhe të përgjegjshme me funksionin e tyre.
I. Struktura e proteinave.
Proteinat paraqesin klasën më të shumtë dhe më të larmishme të përbërjeve organike të qelizës. Proteinat janë heteropolimerë biologjikë monomet e të cilëve janë aminoacidet. të gjithë aminoacidet kanë të paktën një amino grup (-NH2) dhe një grup karboksil (-COOH) dhe ndryshojnë në vetitë strukturore dhe fiziko-kimike të radikalëve.
Peptidet që përmbajnë nga disa mbetje aminoacide në disa dhjetëra ekzistojnë në trup në formë të lirë dhe kanë aktivitet të lartë biologjik. Këto përfshijnë një numër hormonesh (oksitocina, hormoni adrenokortikotropik), disa substanca toksike shumë toksike (për shembull, kërpudhat amanitine), si dhe shumë antibiotikë të prodhuar nga mikroorganizmat.
Proteinat janë polipeptide me peshë të lartë molekulare, të cilat përfshijnë nga njëqind në disa mijëra aminoacide.
II. KLASIFIKIMI I PROTEINIT
Proteinat ndahen në proteina (proteina të thjeshta), që përbëhen vetëm nga mbetje aminoacide, dhe proteide (proteina komplekse), të cilat me anë të hidrolizës prodhojnë aminoacide dhe substanca jo proteinike (acid fosforik, karbohidrate, komponime heterociklike, acide nukleike). Proteinat dhe proteidet ndahen në një numër nëngrupesh.
proteinat
Albumet janë proteina me një peshë molekulare relativisht të vogël që shpërndahen mirë në ujë. Nga tretësirat ujore janë kripur me një solucion të ngopur të sulfatit të amoniumit, koagulohet (denatyrohet) pas ngrohjes. Proteina e vezëve është një përfaqësues tipik i albuminës. Shumë prej tyre janë marrë në një gjendje kristaline.
Globulinat janë proteina që janë të tretshme në ujë të pastër, por të tretshëm në një zgjidhje të ngrohtë 10% Nacl. Globulina e pastër rikuperohet duke holluar kripur me shumë ujë. Globulin - proteinat më të zakonshme, janë pjesë e fibrave të muskujve, gjaku, qumështi, vezët, farat e bimëve.
Prolaminat janë pak të tretshëm në ujë. Shpërndahet në 60-80% etanol ujor. Gjatë hidrolizës së prolaminave, formohet një sasi e madhe e aminoacideve - prolina. Karakteristikë e farave të drithërave. Një shembull është gliadin, proteina kryesore në gluten e grurit.
Glutelinat janë të tretshëm vetëm në 0.2% alkali. Gjeni në farat e grurit, orizit, misrit.
Protaminat - gjenden vetëm në qumështin e peshkut. 80% përbëhen nga aminoacidet alkaline, prandaj ato janë baza të forta. Absolutisht pa squfur.
Skleroproteinat janë proteina të patretshme që kanë një formë të formuluar (fibrillare) të molekulave. Përmbajnë squfur. Këto përfshijnë kolagjen (proteina të kërcit, disa eshtra), elastinë (proteina të tendinave, inde lidhëse), keratin (proteina të flokëve, brirë, thundra, shtresa e sipërme e lëkurës), fibroinë (proteina e fijeve të mëndafshta të para).
Proteid. Proteinat komplekse ndahen në grupe në varësi të përbërjes së pjesës së tyre jo proteinike, e cila quhet grupi protetik. Pjesa proteinike e proteinave komplekse quhet apoproteina.
Lipoproteinat - hidrolizohen në proteina dhe lipide të thjeshta. Lipoproteinat përmbahen në sasi të mëdha në përbërjen e kokrrave të klorofilit dhe protoplazmën e qelizave, membranave biologjike.
Glikoproteinat - hidrolizohen në proteina të thjeshta dhe karbohidrate me peshë të lartë molekulare. Jo i tretshëm në ujë, por i tretshëm në alkalet e holluara. Përmban në sekrecione të ndryshme mukoze të kafshëve, në të bardhën e vezëve,
Kromoproteinat - hidrolizohen në proteina dhe ngjyra të thjeshta. Për shembull, hemoglobina në gjak prishet në një proteinë globin dhe një bazë komplekse azotike që përmban hekur.
Nukleoproteinat - hidrolizohen në proteina të thjeshta, zakonisht protamina, ose histone, dhe acide nukleike.
Fosfoproteinat - përmbajnë acid fosforik. Ata luajnë një rol të madh në ushqimin e një trupi të ri. Një shembull është kazeina - proteina e qumështit.
III. ORGANIZIMI Struktural i MOLEKULEVE PROTEIN
Meqenëse proteinat përbëhen nga disa dhjetëra aminoacide të lidhura në një zinxhir polipeptid, është energjikisht e pafavorshme që qeliza t’i mbajë ato në formën e një zinxhiri (e ashtuquajtura forma e zgjeruar). Prandaj, proteinat kompaktësohen, vendosen, si rezultat i së cilës ata fitojnë një organizim të caktuar hapësinor - strukturë hapësinore.
Ekzistojnë 4 nivele të organizimit hapësinor të proteinave.
Struktura parësore është sekuenca e aminoacideve në përbërjen e zinxhirit polipeptid dhe përcaktohet nga sekuenca e nukleotideve në rajonin e molekulës së ADN-së që kodon këtë proteinë. Struktura kryesore e çdo proteine \u200b\u200bështë unike dhe përcakton formën, vetitë dhe funksionet e saj.
Struktura sekondare e shumicës së proteinave ka formën e një spiraleje dhe lind si rezultat i formimit të lidhjeve hidrogjen midis - CO - dhe NH - grupeve të mbetjeve të ndryshme aminoacide të zinxhirit polipeptid.
Struktura terciare merr formën e një mbështjellje ose globule, dhe formohet si rezultat i një palosjeje hapësinore komplekse të një molekule proteine. Typedo lloj proteine \u200b\u200bkarakterizohet nga një formulë specifike e globulës. Fortësia e strukturës terciare sigurohet nga lidhje të ndryshme që lindin midis radikalëve të aminoacideve (disulfide, jonike, hidrofobike).
Struktura kuaternare është një kompleks kompleks që kombinon disa struktura terciare (për shembull, proteina e hemoglobinës formohet nga katër globula) të mbajtura së bashku nga lidhje jo kovalente: jonike, hidrogjen dhe hidrofobik.
Një ndryshim në formën hapësinore, dhe për rrjedhojë edhe vetitë dhe aktiviteti biologjik i proteinës amtare, quhet denaturim. Denaturimi mund të jetë i kthyeshëm dhe i pakthyeshëm. Në rastin e parë, struktura kuaternare, terciare ose sekondare është shkelur dhe procesi i kundërt i restaurimit të strukturës së proteinave është i mundur - rinaturimi, në të dytën - lidhjet peptide në strukturën parësore janë prishur. Denaturimi shkaktohet nga ndikimet kimike, temperatura e lartë (mbi 45 gradë C), rrezatimi, presioni i lartë, etj.
V. Izolimi i proteinave
Proteinat nxirren nga materiali natyral me ujë, zgjidhje të kripërave, alkalave, acideve, solucioneve të ujit-alkoolit. Produkti i marrë kështu zakonisht përmban një sasi të konsiderueshme papastërtish. Për izolimin dhe pastrimin e mëtejshëm të proteinave, tretësira trajtohet me kripëra (kriposja), ngopur me alkool ose aceton, dhe neutralizohet. Në këtë rast, fraksioni i proteinave përkatëse lëshohet. Shtë shumë e vështirë të izolohet proteina në një gjendje të pandryshuar, për këtë është e nevojshme të vëzhgoni një numër kushtesh: temperaturat e ulëta, një reagim i caktuar i mjedisit, etj.
Proteinat e izoluara dhe të pastruara në shumicën e rasteve janë pluhur i bardhë ose ruajnë formën e tyre natyrore (për shembull, proteinat e leshit dhe mëndafshit).
Për nga forma e molekulave, proteinat mund të ndahen në dy grupe: fibrilare, ose formiforme, dhe globulare, ose sferike. Proteinat fibrile, si rregull, kryejnë funksione të formimit të strukturës. Karakteristikat e tyre (forca, shtrirja) varen nga metoda e paketimit të zinxhirëve polipeptidë, prandaj, pas izolimit, proteinat zakonisht mbajnë formën e tyre natyrore. Fibroina e mëndafshit, keratinat, kolagjenët mund të shërbejnë si një shembull i proteinave fibrilare.
Grupi i dytë përfshin shumicën e proteinave që gjenden në trupin e njeriut. Proteinat globulare karakterizohen nga prania e vendeve me reaktivitet të lartë (ato mund të jenë qendra katalitike të enzimave) ose të formojnë komplekse me molekula të tjera për shkak të grupeve funksionale që janë afër njëra-tjetrës në hapësirë.
VI. Reaksione të proteinave me ngjyra
Proteinat karakterizohen nga disa reagime ngjyrash të shoqëruara me praninë e grupeve të caktuara dhe mbetjeve të aminoacideve në molekulën e tyre.
Reagimi biuret - shfaqja e njollosjes vjollce gjatë përpunimit të proteinave me tretësirë \u200b\u200btë përqendruar alkalin dhe zgjidhje të ngopur CuSO4. Shoqërohet me praninë e lidhjeve peptide në molekulë.
Reagimi i Xanthoproteinës - shfaqja e një ngjyre të verdhë si rezultat i veprimit të acidit nitrik të përqendruar në proteina. Reagimi shoqërohet me praninë e unazave aromatike në proteinë.
Reagimi milion - shfaqja e ngjyrosjes së qershisë së kuqe kur ekspozohet ndaj proteinave të Magentit Milion (një zgjidhje e nitrateve të merkurit në acidin nitrat). Reagimi shpjegohet me praninë e grupeve fenolike në proteinë.
Reagimi Sulfhydryl - reshja e një precipitati të zi të sulfurit të plumbit gjatë ngrohjes së proteinës me një zgjidhje plusbitbit (për shkak të pranisë së grupeve sulfhidryl në proteinë).
Reagimi i Adamkevich është shfaqja e njollosjes vjollce kur shtohen acidet glukokale dhe të përqendruara të sulfurit në proteinë. Ajo shoqërohet me praninë e grupeve indole.
VII. PETRCAKTIMI I STRUKTURS PARIMORE TARY PROTEINIT
Për të deshifruar strukturën parësore të një proteine \u200b\u200bdo të thotë të vendosni formulën e saj, d.m.th., për të përcaktuar në cilën sekuencë mbetjet e aminoacideve janë të vendosura në zinxhirin polipeptid.
Njohuritë për strukturën parësore të proteinave ilustrohen mirë nga puna e Ingram, i cili hulumtoi shkaqet e një sëmundjeje të trashëguar të gjakut, të ashtuquajturat anemi në formë drapri, e cila është e përhapur në disa pjesë të Afrikës dhe Mesdheut. Pacientët me anemi drapër janë të zbehtë, ankohen për dobësi, gulçim në ushtrimin më të vogël. Ata rrallë jetojnë në 12-17 vjet. Gjatë një testi gjaku, gjendet një formë e pazakontë e qelizave të kuqe të gjakut. Qelizat e kuqe të gjakut tek pacientët kanë formën e drapërave ose gjysëm hënave, ndërsa qelizat e kuqe normale të gjakut kanë formën e disqeve biconcave. Një studim i hollësishëm zbuloi se hemoglobina në qelizat e kuqe të shëndetshme të gjakut shpërndahet në mënyrë uniforme dhe rastësore në të gjithë qelizën, ndërsa në qelizat e kuqe të gjakut të pacientëve me anemi, hemoglobina formon strukturën e saktë kristaline. Për shkak të kristalizimit të hemoglobinës, ndodh deformimi i qelizave të kuqe të gjakut. Cila është arsyeja e një ndryshimi kaq të rëndësishëm në hemoglobinë? Ingram izoloi hemoglobinën nga gjaku i pacientëve me sëmundje të sëmurë dhe analizoi strukturën parësore të saj. U zbulua se ndryshimi midis hemoglobinës së pacientëve dhe hemoglobinës së shëndetshme konsiston vetëm në faktin se në zinxhirin polipetpid të hemoglobinës së pacientëve në vendin e 6-të (nga N-terminali) është pjesa tjetër e valinës (bosht), ndërsa hemoglobina e shëndetshme është acidi glutaline (glu). Një molekulë e hemoglobinës përbëhet nga katër nën-njësi (katër zinxhirë polipeptidësh - - dy alfa dhe dy beta me një numër të përgjithshëm të mbetjeve të aminoacideve të barabarta me: 141? 2 + 146? 2 + 574. Zëvendësimi i "glu" me "bosht" bëhet në zinxhirët alfa, t dmth, në dy zinxhirë prej katër. Kështu, në një molekulë të përbërë nga 574 mbetje aminoacide, është e mjaftueshme të zëvendësohen vetëm dy, dhe të lihen të mbetura 572 të pandryshuara, në mënyrë që të ndodhin ndryshime të thella në vetitë e hemoglobinës. pasoja fatale d Unë jam në shëndetin e njeriut.
Sanger (Kembrixh, Angli) qysh në vitet 40 filloi të deshifrojë strukturën parësore të proteinës së insulinës. Gjatë hulumtimit marramendës dhe kërkon kohë, Sanger zhvilloi një numër metodash dhe teknikash të reja të analizës. Këto vepra u kryen nga ai për më shumë se 10 vjet dhe u kurorëzuan me sukses të plotë: u krijua formula e insulinës, dhe për arritjet e tij të jashtëzakonshme autorit iu dha Nobmimi Nobel (1958). Rëndësia e punës së Sangerit konsiston jo vetëm në deshifrimin e strukturës parësore të insulinës, por edhe në atë përvojë të fituar, u zhvilluan metoda të reja dhe u vërtetua realiteti i këtyre studimeve. Pas punës së Sanger, ishte më lehtë të bëhej për studiuesit e tjerë. Në të vërtetë, pas Singerit, shumë laboratorë filluan të deshifrojnë strukturën parësore të një numri proteinash, të përmirësojnë metodat e analizës dhe të zhvillojnë metoda të reja.
VIII. Funksionet e proteinave
katalitik
Proteinat - enzimat prodhohen nga organizmat e gjallë; ato kanë një efekt katalitik, domethënë aftësinë për të rritur normat e reaksioneve të caktuara kimike. Proceset e fermentimit bazohen në veprime enzimatike, të cilat janë përdorur që nga kohërat parahistorike në prodhimin e verërave, uthullit, birrës dhe bukës. Më 1680, natyralisti Hollandez Anthony Levenguk përdori një mikroskop të modelit të tij për të vëzhguar qelizat e majave dhe baktereve; megjithatë, ai nuk i konsideronte ata organizma të gjallë. Në 1857, Louis Pasteur tregoi se maja është një organizëm i gjallë, dhe fermentimi është një proces fiziologjik. Në 1897, E. Büchner ishte në gjendje të provonte që fermentimi mund të ndodhë pa pjesëmarrjen e qelizave të tharmit. Pasi nxori qelizat e majave, ai mori një zgjidhje që nuk përmbante qeliza, por posedonte aktivitet enzimatik (që përmban një enzimë, ose enzimë). Fjala "enzimë" vjen nga greqishtja en 2yme - në majanë.
Deri në vitin 1926, nuk u mor asnjë provë që tregon se enzimat janë proteina. Vetëm në vitin 1926, James B. Sumner (1887-1955), i cili punoi në Universitetin Cornell, ishte në gjendje të izolonte soje të pastër dhe të merrte në formë kristaline enzimën e ureazës urease - një proteinë që katalizon ndarjen hidrolitike të ure
CO (NH2) 2 + H2O - CO2 + 2NH3
Pesha molekulare e ureazës është 480000; molekula përbëhet nga gjashtë nën-njësi.
Dihet rreth 2,000 enzima të ndryshme, disa prej tyre janë studiuar në detaje. Sipas klasifikimit modern, të gjitha enzimat ndahen në gjashtë klasa.
1. Oxyreductases ose enzima redox. Ky është një grup i madh i përbërë nga 180-190 enzima. Oksiduktaksat përshpejtojnë oksidimin ose zvogëlimin e kimikateve të ndryshme. Kështu, enzima e dehidrogjenazës së alkoolit që i përket kësaj klase katalizon oksidimin e alkoolit etilik në aldehide acetike dhe luan një rol të madh në procesin e fermentimit alkoolik.
Lipzigjenaza enzimë oksidon acidet yndyrore të pangopura me oksigjen atmosferik. Veprimi i kësaj enzime është një nga shkaqet e shkathtësisë së miellit dhe drithërave.
2. Transferaza. Përfaqësuesit e këtij grupi të enzimave katalizojnë transferimin e grupeve të ndryshme nga një molekulë në një tjetër, për shembull, enzima tirosinaminotransferazë katalizon transferimin e një grupi amino. Enzimat e këtij grupi luajnë një rol të madh në mjekësi.
3. Hidrolazat. Enzimat e këtij grupi katalizojnë reaksionet e hidrolizës. Përfaqësuesit e këtij grupi të enzimave kanë një rëndësi të madhe në proceset e tretjes, në ushqim dhe industri të tjera. Pra, enzima e lipazës katalizon hidrolizën e glicerideve me formimin e acideve yndyrore të lira dhe glicerinës. Hidroliza e substancave pektinore ndodh me pjesëmarrjen e enzimave pektolitike, përdorimi i tyre bën të mundur rritjen e rendimentit dhe sqarimin e lëngjeve të frutave dhe manave.
Përfaqësuesi i grupit të hidrolazës janë amilazat që katalizojnë hidrolizën e niseshtës. Ato përdoren gjerësisht në industrinë e alkoolit, buke, niseshte dhe shurup.
Hidrolazat përfshijnë një grup të madh enzimesh proteolitike që katalizojnë hidrolizën e proteinave dhe peptideve. Ato përdoren në industri të lehta dhe ushqimore. Me ndihmën e tyre ata transportojnë "zbutjen" e mishit, lëkurës dhe prodhimin e djathrave.
4. Lyases. Reagimet e dekompozimit midis atomeve të karbonit, karbonit dhe oksigjenit, karbonit dhe azotit, karbonit dhe halogjenit janë katalizuar. Enzimat e këtij grupi përfshijnë dekarbboxylaza që pastrojnë molekulën e dioksidit të karbonit nga acidet organike.
etj .................
proteinat Janë biopolimerët që përbëhen nga mbetjet e α-aminoacideve të ndërlidhura nga lidhjet peptide (-CO-NH-). Proteinat janë pjesë e qelizave dhe indeve të të gjithë organizmave të gjallë. Molekulat e proteinave përfshijnë 20 mbetje të aminoacideve të ndryshme.
Struktura e proteinave
Proteinat kanë një larmi të pashtershme strukturash.
Struktura primare e proteinave Shtë një sekuencë e njësive të aminoacideve në një zinxhir linear polipeptidik.
Struktura sekondare Shtë një konfigurim hapësinor i një molekule proteine, që i ngjan një spiraleje, e cila formohet si rezultat i kthesës së një zinxhiri polipeptid për shkak të lidhjeve hidrogjen midis grupeve: CO dhe NH.
Struktura terciare - Kjo është konfigurimi hapësinor që zinxhiri polipeptid, i cili është i shtrembëruar në një spirale, merr.
Struktura kuaternare Janë formacione polimer të disa makromolekulave proteinike.
Karakteristikat fizike
Karakteristikat e proteinave janë shumë të ndryshme, të cilat ato i kryejnë. Disa proteina shpërndahen në ujë, duke formuar, si rregull, zgjidhje koloidale (për shembull, të bardhë veze); të tjerët shpërndahen në solucione të holluara kripe; ato të tretat janë të pazgjidhshme (për shembull, proteinat e indeve integruese).
Karakteristikat kimike
1. Denaturimi - shkatërrimi i strukturës sekondare, terciare të proteinës nën ndikimin e faktorëve të ndryshëm: temperaturën, veprimin e acideve, kripërat e metaleve të rënda, alkoolet, etj.
2. Reaksione cilësore ndaj proteinave:
a) Kur digjen proteina - erë e pendëve të kënduara.
b) proteina + HNO 3 color ngjyra e verdhë
c) tretësirë \u200b\u200bproteine \u200b\u200b+ NaOH + CuSO 4 color ngjyra vjollce
3. Hidrolizë
Përzierje proteine \u200b\u200b+ H 2 O → aminoacide
Funksionet e proteinave në natyrë:
Katalitik (enzima);
· Rregullues (hormonet);
Strukturore (leshi i keratinës, fibroina e mëndafshit, kolagjeni);
Motor (actin, myosin);
· Transporti (hemoglobina);
Kembim (kazeinë, albumin e vezëve);
Mbrojtës (imunoglobulinat), etj.
25. Karakteristikat e përgjithshme të komponimeve makromolekulare: përbërja, struktura, reaksionet në themel të prodhimit të tyre (për shembull, polietileni ose gome sintetike).
Komponime me peshë të lartë molekulare (IUD) ose polimere substancat me një peshë të madhe molekulare, të përbërë nga shumë njësi strukturore të përsëritura, quhen. Ka polimere natyrale (niseshte, proteina, celulozë, gome) dhe polimere sintetike (polietileni, plastika fenolike). Substancat me peshë të ulët molekulare nga e cila sintetizohen polimeret quhen monomere.
CH2 \u003d monomer CH 2 i polietilenit - etilenit
(-CH 2 -CH 2 -) n - molekula polimer
CH 2 -CH 2 - - njësi strukturore - një grup përsëritës i atomeve
n është shkalla e polimerizimit (numri i njësive në molekulën e polimerit)
Pesha molekulare e polimerit është e ndryshueshme dhe varet nga numri n. Makromolekulat e polimereve mund të kenë një strukturë hapësinore të ndryshme:
1. lineare (polietileni, polipropileni);
2. Degë (niseshte);
3. Hapësinore (gome).
Karakteristikat fizike
Polimerët kanë forcë të lartë mekanike. Kimikisht rezistent (mos reagoni me acide dhe alkalat). Ata nuk kanë një pikë të shkrirjes specifike, nuk shpërndahen në ujë dhe në shumicën e tretësve organikë.
Sinteza polimerike
Polimerët sintetizohen në dy mënyra:
1. Reaksioni i polimerizimit;
2. Reaksioni i polikondensimit.
Reagimi i polimerizimit quhet procesi i ndërthurjes së molekulave monomerike në molekula më të mëdha.
n CH2 \u003d CH 2 → (-CH 2-CH2 -) n
polietileni etilen
polietilen - material i tejdukshëm, i yndyrshëm në prekje, rezistent ndaj ajrit dhe lagështisë, i shkriftshëm, kimikisht rezistent, nuk kalbet, dielektrik. Përdoret për prodhimin e filmave, tubave, produkteve shtëpiake (enët, lodrat), izolimin elektrik, veshjet sipërfaqësore.
"Jeta është një mënyrë e ekzistencës së trupave proteinikë"
F. Engels.
paraqitje
Proteinat së bashku me acidet nukleike, lipidet, karbohidratet, disa substanca organike me peshë të ulët molekulare, kripëra minerale dhe ujë formojnë protoplazmën e të gjithë organizmave tokësorë - kafshëve dhe bimëve, komplekse dhe elementare. Termi "protoplazëm" u propozua nga fiziologu çek Purkine (1839) për t'iu referuar përmbajtjes së një qelize të gjallë. Përmbajtja e proteinave në protoplazmë, si rregull, është dukshëm më e lartë se të gjithë përbërësit e tjerë të saj (duke mos llogaritur ujë). Në shumicën e rasteve, proteinat përbëjnë deri në 75-80% të masës së thatë të qelizave.
Substancat proteinike paraqesin pjesën kryesore, më aktive të protoplazmës: "Karakteristikat e atij komponenti, i cili është i pranishëm në një sasi më të madhe dhe që është më aktive, shkëlqejnë përmes protoplazmës më qartë" A. Danilevsky (substanca kryesore e protoplazmës dhe modifikimi i tij nga jeta. 1894).
Besimi për rëndësinë e shkallës së parë të proteinave për jetën mbetet i palëkundur edhe në kohën tonë, megjithë zbulimin e rolit të acideve nukleike në fenomenet e trashëgimisë, sqarimin e rëndësisë jetike për vitaminat, hormonet, etj.
Për shkak të karakteristikave të përbërjes dhe strukturës së tyre, proteinat shfaqin një larmi të jashtëzakonshme të vetive fizike dhe kimike. Proteinat që janë plotësisht të tretshme në ujë janë të njohura, ka proteina që janë jashtëzakonisht të paqëndrueshme, duke ndryshuar nën ndikimin e dritës së dukshme ose edhe një prekje të lehtë mekanike. Ka proteina, molekulat e të cilave duken si filamente që arrijnë një gjatësi prej disa milimetra, dhe ka proteina, molekulat e të cilave janë topa me dhjetëra kënde në diametër. Por në të gjitha rastet, struktura dhe vetitë e proteinave janë në një lidhje të ngushtë dhe të përgjegjshme me funksionin e tyre.
I. Struktura e proteinave.
Proteinat paraqesin klasën më të shumtë dhe më të larmishme të përbërjeve organike të qelizës. Proteinat janë heteropolimere biologjikemonomeret e të cilave janë aminoacidet. të gjithë aminoacidet kanë të paktën një amino grup (—NH2) dhe një grup karboksil (OOCOOH) dhe ndryshojnë në vetitë strukturore dhe fiziko-kimike të radikalëve (R).
Peptidet që përmbajnë nga disa mbetje aminoacide në disa dhjetëra ekzistojnë në trup në formë të lirë dhe kanë aktivitet të lartë biologjik. Këto përfshijnë një numër hormonesh (oksitocina, hormoni adrenokortikotropik), disa substanca toksike shumë toksike (për shembull, kërpudhat amanitine), si dhe shumë antibiotikë të prodhuar nga mikroorganizmat.
Proteinat janë polipeptide me peshë të lartë molekulare, të cilat përfshijnë nga njëqind në disa mijëra aminoacide.
II. Klasifikimi i proteinave
Proteinat ndahen në proteina (proteina të thjeshta), që përbëhen vetëm nga mbetje aminoacide, dhe proteide (proteina komplekse), të cilat me anë të hidrolizës prodhojnë aminoacide dhe substanca jo proteinike (acidi fosforik, karbohidratet, komponimet heterociklike, acidet nukleike). Proteinat dhe proteidet ndahen në një numër nëngrupesh.
proteinat
Albumet janë proteina me një peshë molekulare relativisht të vogël që shpërndahen mirë në ujë. Nga tretësirat ujore janë kripur me një solucion të ngopur të sulfatit të amoniumit, koagulohet (denatyrohet) pas ngrohjes. Vezë e bardhë - Një përfaqësues tipik i albumines. Shumë prej tyre janë marrë në një gjendje kristaline.
Globulinat janë proteina që janë të tretshme në ujë të pastër, por të tretshëm në një zgjidhje të ngrohtë 10% Nacl. Globulina e pastër rikuperohet duke holluar kripur me shumë ujë. Globulin - proteinat më të zakonshme, janë pjesë e fibrave të muskujve, gjaku, qumështi, vezët, farat e bimëve.
Prolaminat janë pak të tretshëm në ujë. Shpërndahet në 60-80% etanol ujor. Gjatë hidrolizës së prolaminave, formohet një sasi e madhe e aminoacideve - prolina. Karakteristikë e farave të drithërave. Një shembull është gliadin - kryesor proteina gluten gruri.
Glutelinat janë të tretshëm vetëm në 0.2% alkali. Gjeni në farat e grurit, orizit, misrit.
Protaminat - gjenden vetëm në qumështin e peshkut. 80% përbëhen nga aminoacidet alkaline, prandaj ato janë baza të forta. Absolutisht pa squfur.
Skleroproteinat janë proteina të patretshme që kanë një formë të formuluar (fibrillare) të molekulave. Përmbajnë squfur. Këto përfshijnë kolagjen (proteina të kërcit, disa eshtra), elastinë (proteina të tendinave, inde lidhëse), keratin (proteina të flokëve, brirë, thikë, shtresa e sipërme e lëkurës), fibroinë (proteina e fijeve të mëndafshta të para).
Proteid. Proteinat komplekse ndahen në grupe në varësi të përbërjes së pjesës së tyre jo proteinike, e cila quhet grupi protetik. Pjesa proteinike e proteinave komplekse quhet apoproteina.
Lipoproteinat - hidrolizohen më tej proteina dhe lipide të thjeshta. Lipoproteinat përmbahen në sasi të mëdha në përbërjen e kokrrave të klorofilit dhe protoplazmën e qelizave, membranave biologjike.
Glikoproteinat - hidrolizohen në proteina të thjeshta dhe karbohidrate me peshë të lartë molekulare. Jo i tretshëm në ujë, por i tretshëm në alkalet e holluara. Përmban në sekrecione të ndryshme mukoze të kafshëve, në të bardhën e vezëve,
Kromoproteinat - hidrolizohen në proteina dhe ngjyra të thjeshta. Për shembull, hemoglobina në gjak prishet në një proteinë globin dhe një bazë komplekse azotike që përmban hekur.
Nukleoproteinat - hidrolizohen në proteina të thjeshta, zakonisht protamina, ose histone, dhe acide nukleike.
Fosfoproteinat - përmbajnë acid fosforik. Ata luajnë një rol të madh në ushqimin e një trupi të ri. Kazeina është kazeinë - proteina e qumështit.
III. Organizimi strukturor i molekulave të proteinave
Meqenëse proteinat përbëhen nga disa dhjetëra aminoacide të lidhura në një zinxhir polipeptid, është energjikisht e pafavorshme që qeliza t’i mbajë ato në formën e një zinxhiri (e ashtuquajtura forma e zgjeruar). Prandaj, proteinat kompaktësohen, vendosen, si rezultat i së cilës ata fitojnë një organizim të caktuar hapësinor - strukturë hapësinore.
Ekzistojnë 4 nivele të organizimit hapësinor të proteinave.
Struktura parësore është sekuenca e aminoacideve në përbërjen e zinxhirit polipeptid dhe përcaktohet nga sekuenca e nukleotideve në rajonin e molekulës së ADN-së që kodon këtë proteinë. Struktura kryesore e çdo proteine \u200b\u200bështë unike dhe përcakton formën, vetitë dhe funksionet e saj.
Struktura sekondare e shumicës së proteinave ka formën e një spiraleje dhe lind si rezultat i formimit të lidhjeve hidrogjen midis - CO - dhe NH - grupeve të mbetjeve të ndryshme aminoacide të zinxhirit polipeptid.
Struktura terciare merr formën e një mbështjellje ose globule, dhe formohet si rezultat i një palosjeje hapësinore komplekse të një molekule proteine. Typedo lloj proteine \u200b\u200bkarakterizohet nga një formulë specifike e globulës. Fortësia e strukturës terciare sigurohet nga lidhje të ndryshme që lindin midis radikalëve të aminoacideve (disulfide, jonike, hidrofobike).
Struktura kuaternare është një kompleks kompleks që kombinon disa struktura terciare (për shembull, proteina e hemoglobinës formohet nga katër globula) të mbajtura së bashku nga lidhje jo kovalente: jonike, hidrogjen dhe hidrofobik.
Një ndryshim në formën hapësinore, dhe për rrjedhojë edhe vetitë dhe aktiviteti biologjik i proteinës amtare, quhet denaturim. Denaturimi mund të jetë i kthyeshëm dhe i pakthyeshëm. Në rastin e parë, struktura kuaternare, terciare ose sekondare është shkelur dhe procesi i kundërt i restaurimit të strukturës së proteinave është i mundur - rinaturimi, në të dytën - lidhjet peptide në strukturën parësore janë prishur. Denaturimi shkaktohet nga ndikimet kimike, temperatura e lartë (mbi 45 gradë C), rrezatimi, presioni i lartë, etj.
V. Izolimi i proteinave
Proteinat nxirren nga materiali natyral me ujë, zgjidhje të kripërave, alkalave, acideve, solucioneve të ujit-alkoolit. Produkti i marrë kështu zakonisht përmban një sasi të konsiderueshme papastërtish. Për izolimin dhe pastrimin e mëtejshëm të proteinave, tretësira trajtohet me kripëra (kriposja), ngopur me alkool ose aceton, dhe neutralizohet. Në këtë rast, fraksioni i proteinave përkatëse lëshohet. Shtë shumë e vështirë të izolohet proteina në një gjendje të pandryshuar, për këtë është e nevojshme të vëzhgoni një numër kushtesh: temperaturat e ulëta, një reagim i caktuar i mjedisit, etj.
Proteinat e izoluara dhe të pastruara në shumicën e rasteve janë pluhur i bardhë ose ruajnë formën e tyre natyrore (për shembull, proteinat e leshit dhe mëndafshit).
Për nga forma e molekulave, proteinat mund të ndahen në dy grupe: fibrilare, ose formiforme, dhe globulare, ose sferike. Proteinat fibrile, si rregull, kryejnë funksione të formimit të strukturës. Karakteristikat e tyre (forca, shtrirja) varen nga metoda e paketimit të zinxhirëve polipeptidë, prandaj, pas izolimit, proteinat zakonisht mbajnë formën e tyre natyrore. Fibroina e mëndafshit, keratinat, kolagjenët mund të shërbejnë si një shembull i proteinave fibrilare.
Grupi i dytë përfshin shumicën e proteinave që gjenden në trupin e njeriut. Proteinat globulare karakterizohen nga prania e vendeve me reaktivitet të lartë (ato mund të jenë qendra katalitike të enzimave) ose të formojnë komplekse me molekula të tjera për shkak të grupeve funksionale që janë afër njëra-tjetrës në hapësirë.
VI. Reagimet e ngjyrave të proteinave
Proteinat karakterizohen nga disa reagime ngjyrash të shoqëruara me praninë e grupeve të caktuara dhe mbetjeve të aminoacideve në molekulën e tyre.
Reagimi biuret - shfaqja e njollosjes vjollce kur përpunoni një proteinë me një zgjidhje të përqendruar alkalin dhe një zgjidhje të ngopur të CuSO 4. Shoqërohet me praninë e lidhjeve peptide në molekulë.
Reagimi i Xanthoproteinës - shfaqja e një ngjyre të verdhë si rezultat i veprimit të acidit nitrik të përqendruar në proteina. Reagimi shoqërohet me praninë e unazave aromatike në proteinë.
Reagimi milion - shfaqja e ngjyrosjes së qershisë së kuqe kur ekspozohet ndaj proteinave të Magentit Milion (një zgjidhje e nitrateve të merkurit në acidin nitrat). Reagimi shpjegohet me praninë e grupeve fenolike në proteinë.
Reagimi Sulfhydryl - reshja e një precipitati të zi të sulfurit të plumbit gjatë ngrohjes së proteinës me një zgjidhje plusbitbit (për shkak të pranisë së grupeve sulfhidryl në proteinë).
Reagimi i Adamkevich është shfaqja e njollosjes vjollce kur shtohen acidet glukokale dhe të përqendruara të sulfurit në proteinë. Ajo shoqërohet me praninë e grupeve indole.
VII. Deshifrimi i strukturës primare të proteinës
Për të deshifruar strukturën parësore të një proteine \u200b\u200bdo të thotë të vendosni formulën e saj, d.m.th., për të përcaktuar në cilën sekuencë mbetjet e aminoacideve janë të vendosura në zinxhirin polipeptid.
Njohuritë për strukturën parësore të proteinave ilustrohen mirë nga puna e Ingram, i cili hulumtoi shkaqet e një sëmundjeje të trashëguar të gjakut, të ashtuquajturat anemi në formë drapri, e cila është e përhapur në disa pjesë të Afrikës dhe Mesdheut. Pacientët me anemi drapër janë të zbehtë, ankohen për dobësi, gulçim në ushtrimin më të vogël. Ata rrallë jetojnë në 12-17 vjet. Gjatë një testi gjaku, gjendet një formë e pazakontë e qelizave të kuqe të gjakut. Qelizat e kuqe të gjakut tek pacientët kanë formën e drapërave ose gjysëm hënave, ndërsa qelizat e kuqe normale të gjakut kanë formën e disqeve biconcave. Një studim i hollësishëm zbuloi se hemoglobina në qelizat e kuqe të shëndetshme të gjakut shpërndahet në mënyrë uniforme dhe rastësore në të gjithë qelizën, ndërsa në qelizat e kuqe të gjakut të pacientëve me anemi, hemoglobina formon strukturën e saktë kristaline. Për shkak të kristalizimit të hemoglobinës, ndodh deformimi i qelizave të kuqe të gjakut. Cila është arsyeja e një ndryshimi kaq të rëndësishëm në hemoglobinë? Ingram izoloi hemoglobinën nga gjaku i pacientëve me sëmundje të sëmurë dhe analizoi strukturën parësore të saj. U zbulua se ndryshimi midis hemoglobinës së pacientëve dhe hemoglobinës së shëndetshme konsiston vetëm në faktin se në zinxhirin polipetpid të hemoglobinës së pacientëve në vendin e 6-të (nga N-terminali) është pjesa tjetër e valinës (bosht), ndërsa në të njëjtin vend në hemoglobina e shëndetshme është acidi glutaline (glu). Molekula e hemoglobinës përbëhet nga katër nën-njësi (katër zinxhirë polipeptidësh - - dy alfa dhe dy betta me një numër të përgjithshëm të mbetjeve të aminoacideve të barabarta me: 141x2 + 146x2 + 574. Zëvendësimi i "glu" me "bosht" bëhet në zinxhirët alfa, d.m.th. dy zinxhirë prej katër. Kështu, në një molekulë të përbërë nga 574 mbetje aminoacidesh, është e mjaftueshme të zëvendësohen vetëm dy, dhe të lini të mbetura 572 të pandryshuara, në mënyrë që të ndodhin ndryshime të thella në vetitë e hemoglobinës. Nëse ndryshoni aftësinë e tij për t’u kristalizuar dhe lidhur oksigjen, atëherë do të ndodhin pasoja fatale Një shëndetit publik.
Sanger (Kembrixh, Angli) qysh në vitet 40 filloi të deshifrojë strukturën parësore të proteinës së insulinës. Gjatë hulumtimit marramendës dhe kërkon kohë, Sanger zhvilloi një numër metodash dhe teknikash të reja të analizës. Këto vepra u kryen nga ai për më shumë se 10 vjet dhe u kurorëzuan me sukses të plotë: u krijua formula e insulinës, dhe për arritjet e tij të jashtëzakonshme autorit iu dha Nobmimi Nobel (1958). Rëndësia e punës së Sangerit konsiston jo vetëm në deshifrimin e strukturës parësore të insulinës, por edhe në atë përvojë të fituar, u zhvilluan metoda të reja dhe u vërtetua realiteti i këtyre studimeve. Pas punës së Sanger, ishte më lehtë të bëhej për studiuesit e tjerë. Në të vërtetë, pas Singerit, shumë laboratorë filluan të deshifrojnë strukturën parësore të një numri proteinash, të përmirësojnë metodat e analizës dhe të zhvillojnë metoda të reja.
VIII. Funksionet e proteinave
katalitik
Proteinat - enzimat prodhohen nga organizmat e gjallë; ato kanë një efekt katalitik, domethënë aftësinë për të rritur normat e reaksioneve të caktuara kimike. Proceset e fermentimit bazohen në veprime enzimatike, të cilat janë përdorur që nga kohërat parahistorike në prodhimin e verërave, uthullit, birrës dhe bukës. Më 1680, natyralisti Hollandez Anthony Levenguk përdori një mikroskop të modelit të tij për të vëzhguar qelizat e majave dhe baktereve; megjithatë, ai nuk i konsideronte ata organizma të gjallë. Në 1857, Louis Pasteur tregoi se maja është një organizëm i gjallë, dhe fermentimi është një proces fiziologjik. Në 1897, E. Büchner ishte në gjendje të provonte që fermentimi mund të ndodhë pa pjesëmarrjen e qelizave të tharmit. Pasi nxori qelizat e majave, ai mori një zgjidhje që nuk përmbante qeliza, por posedonte aktivitet enzimatik (që përmban një enzimë, ose enzimë). Fjala "enzimë" vjen nga greqishtja en 2yme - në majanë.
Deri në vitin 1926, nuk u mor asnjë provë që tregon se enzimat janë proteina. Vetëm në vitin 1926, James B. Sumner (1887-1955), i cili punoi në Universitetin Cornell, ishte në gjendje të izolonte soje të pastër dhe të merrte në formë kristaline enzimën e ureazës urease - një proteinë që katalizon ndarjen hidrolitike të ure
CO (NH2) 2 + H 2 O - CO 2 + 2NH3
Pesha molekulare e ureazës është 480000; molekula përbëhet nga gjashtë nën-njësi.
Dihet rreth 2,000 enzima të ndryshme, disa prej tyre janë studiuar në detaje. Sipas klasifikimit modern, të gjitha enzimat ndahen në gjashtë klasa.
1. Oxyreductases ose enzima redox. Ky është një grup i madh i përbërë nga 180-190 enzima. Oksiduktaksat përshpejtojnë oksidimin ose zvogëlimin e kimikateve të ndryshme. Kështu, enzima e dehidrogjenazës së alkoolit që i përket kësaj klase katalizon oksidimin e alkoolit etilik në aldehide acetike dhe luan një rol të madh në procesin e fermentimit alkoolik.
Lipzigjenaza enzimë oksidon acidet yndyrore të pangopura me oksigjen atmosferik. Veprimi i kësaj enzime është një nga shkaqet e shkathtësisë së miellit dhe drithërave.
2. Transferaza. Përfaqësuesit e këtij grupi të enzimave katalizojnë transferimin e grupeve të ndryshme nga një molekulë në një tjetër, për shembull, enzima tirosinaminotransferazë katalizon transferimin e një grupi amino. Enzimat e këtij grupi luajnë një rol të madh në mjekësi.
3. Hidrolazat. Enzimat e këtij grupi katalizojnë reaksionet e hidrolizës. Përfaqësuesit e këtij grupi të enzimave kanë një rëndësi të madhe në proceset e tretjes, në ushqim dhe industri të tjera. Pra, enzima e lipazës katalizon hidrolizën e glicerideve me formimin e acideve yndyrore të lira dhe glicerinës. Hidroliza e substancave pektinore ndodh me pjesëmarrjen e enzimave pektolitike, përdorimi i tyre bën të mundur rritjen e rendimentit dhe sqarimin e lëngjeve të frutave dhe manave.
Përfaqësuesi i grupit të hidrolazës janë amilazat që katalizojnë hidrolizën e niseshtës. Ato përdoren gjerësisht në industrinë e alkoolit, buke, niseshte dhe shurup.
Hidrolazat përfshijnë një grup të madh enzimesh proteolitike që katalizojnë hidrolizën e proteinave dhe peptideve. Ato përdoren në industri të lehta dhe ushqimore. Me ndihmën e tyre ata transportojnë "zbutjen" e mishit, lëkurës dhe prodhimin e djathit.
4. Lyases. Reagimet e dekompozimit midis atomeve të karbonit, karbonit dhe oksigjenit, karbonit dhe azotit, karbonit dhe halogjenit janë katalizuar. Enzimat e këtij grupi përfshijnë dekarbboxylaza që pastrojnë molekulën e dioksidit të karbonit nga acidet organike.
5. Izomeraza. Enzimat e këtij grupi katalizojnë një shumëllojshmëri të rirregullimeve brenda molekulës së një përbërësi organik.
6. Ligazat. katalizoni formimin e lidhjeve C - O; C është S; C është N; C - C. Një tipar karakteristik i enzimave është efikasiteti i tyre i lartë (ata janë të aftë të katalizojnë reagimet më komplekse në kushte shumë të buta) dhe një orientim të rreptë. Veprimi i enzimave është jashtëzakonisht i varur nga një numër faktorësh: temperatura (temperatura optimale 30-50 gradë C), aciditeti i mediumit, prania e substancave specifike të quajtura aktivizues dhe frenues. Të parët rrisin aktivitetin e enzimave, të dytat ulen (frenojnë enzimat). Prodhimi industrial i një numri të përgatitjeve enzimë tani është nisur. Përdorimi i tyre në industri të ndryshme jep një efekt të madh ekonomik.
Funksioni ndërtimor - janë përbërësit strukturorë të membranave biologjike dhe shumë organelë ndërqelizorë, përbërësi kryesor i strukturave mbështetëse të trupit (kolagjeni i kërcit dhe tendinave; elastina e indit lidhës; keratinat e flokëve dhe thonjve).
Funksioni i transportit. Një numër i proteinave të gjakut janë në gjendje të bashkojnë dhe transferojnë substanca të ndryshme. Albumi transporton acide yndyrore; alfa dhe beta globulin transportojnë oksigjenin. Funksioni i transportit kryhet nga proteina - bartës të membranave plazmatike.
Funksioni rregullator. Shumë hormone janë substanca të një natyre proteinike, për shembull: insulina, glukagoni (një antagonist i insulinës), hormoni adenokortikotrop (ACTH) dhe disa të tjera.
Funksioni mbrojtës. Kryhet nga imunoglobulinat e gjakut, të cilat janë antitrupa, fibrinë dhe trombinë, të cilat marrin pjesë në koagulimin e gjakut dhe ndalojnë gjakderdhjen. Kjo gjithashtu përfshin një grup enzimesh antioksiduese (superoksid dismutaza - SOD, katalaza), të cilat pengojnë zhvillimin e proceseve radikale të lira që janë jashtëzakonisht të dëmshme për trupin.
Funksioni kontraktues. Për shkak të lëvizjes së fijet e proteinës së aktinës dhe miozinës në raport me njëra-tjetrën, bëhet tkurrja e muskujve.
Funksioni i receptorit. Disa proteina të ngulitura në membranën qelizore formojnë receptorë që "perceptojnë informacionin" nga molekulat e hormonit.
Proteinat dietike - ushqejnë embrionin në fazat e hershme të zhvillimit dhe ruajnë substanca dhe jone biologjikisht të vlefshme (kazeina e qumështit; ferritina, e cila ruan hekurin në shpretkë).
IX. Si të sintetizoni proteinën
Mjaft e çuditshme, nganjëherë është më e lehtë të integrosh një proteinë në mënyrë artificiale sesa të krijosh strukturën e saj. le të njihet struktura e proteinave. Si ta fusni në një enë?
Ne i vendosëm vetes qëllimin për të sintetizuar artificialisht një prej proteinave më të thjeshta - insulinës. Siç kemi thënë tashmë, molekula e insulinës përbëhet nga dy pjesë A dhe B. Natyrisht, ju duhet të merrni të dy zinxhirët veç e veç, dhe pastaj t'i lidhni ato. Pra, sinteza e zinxhirit B është një molekulë insuline. Ne do ta sjellim atë nga C - fundi i zinxhirit. Aminoacidi i parë është alanina. Para së gjithash, marrim bazën në të cilën gradualisht, me anë të acidit, do të rritim zinxhirin e insulinës. Si një bazë e tillë, rrëshirat e shkëmbimit të joneve, polistireni mund të merren. Ne bashkojmë bazën përmes grupit karboksil aminoacidin e parë - alanine.
Pra, alanina nga grupi karboksil është ngjitur në rrëshirë, por amino grupi i saj është i lirë. Tani, amino acidi i mëposhtëm, alanina, duhet të bashkangjitet këtij amino grupi përmes grupit karboksil.
Pra, alanina ishte ngjitur në rrëshirë nga një grup karboksi, por amino grupi i tij është falas. Tani, aminoacidi i mëposhtëm, lisina, duhet t'i bashkëngjitet këtij amino grupi përmes grupit karboksil. Si ta bëjmë atë? Një mënyrë e mirë për të marrë një lidhje amide midis një karboksili dhe një grupi amino është acilimi i këtij të fundit me një klorur acid. Në këtë rast, klorur hidrogjeni lëshohet. Kështu që le ta bëjmë. Merrni klorur lizine dhe veproni ndaj tyre ... Ndaloni! Asgjë e mirë nuk do të vijë prej saj. Fakti është se ekziston një grup amino në vetë lisenin, dhe nuk është e qartë pse kloruri i lisinës duhet të bashkëveprojë vetëm me amino grupin e aminoacidit të parë (alanine), dhe nuk do të prodhojë polizaminë lisin.
Si të jesh? Për të dalë nga kjo situatë, është e nevojshme të mbroni amino grupin e lizinës nga veprimi i klorureve të acidit. Për ta bërë këtë, ajo acilohet me anhidrid të acidit trifluoroacetic. Pse trifluoroacetic, dhe jo vetëm acetik, pse grupi amino thjesht nuk mund të acetilohet, d.m.th i mbrojtur nga COCH 3? Rezulton se grupi acetil "mban fort" grupin amino, dhe qëllimi ynë është ta mbjellim atë "përkohësisht". Trifluoroacetil atëherë lehtë do të "hiqet" pa shkatërruar peptidin që rezulton.
Kjo do të thotë që hapi tjetër është acilimi në grupin amino të "lidhur" me klorurin acid trifluoroacetilated të rrëshirës alanine (gjithashtu në grupin amino) të lisinës. Në rastin e lizinës, lënda është e ndërlikuar, por mund të mbrohet nga disa grupe X, i cili nuk shkëputet prej tij gjatë sintezës dhe hiqet vetëm në fund.
Si rezultat, marrim një dipeptid me një amino grup të mbrojtur. Tani amino grupi duhet të çlirohet. Ne heqim mbrojtjen duke vepruar me një zgjidhje të dobët të alkali, dhe marrim një grup amino falas që mund të marrë aminoacidin tjetër - prolinën.
Faza tjetër është tashmë e qartë - ne veprojmë në peptid me klorur trefluoroacetilated tereonine, etj., Derisa të ndërtojmë të gjithë zinxhirin e 30 aminoacideve. Ne bashkojmë acidin e fundit - fenilalaninë, heqim grupin mbrojtës dhe, duke vepruar me acid, shkëputim zinxhirin e përfunduar nga rrëshira.
Në të njëjtën mënyrë, ne sintetizojmë zinxhirin e dytë, lidhim të dy zinxhirët, dhe insulina artificiale është gati! Jo aq e thjeshtë dhe jo aq e shpejtë, është? Po, puna kërkon durim dhe kohë.
Sidoqoftë, në vitin 1968, Maryfield arriti të sintetizojë një proteinë relativisht komplekse - enzimën e ribonuklezës. Përbëhet nga 124 aminoacide. Kjo sintezë përfshinte fazën 11931 (e ngjashme me ato që ne thjesht u disassembled), ajo u krye në vetëm tre javë.
X. Përfundimi
Sinteza e proteinave në laborator është arritja kurorëzuese e kimisë bioorganike të shekullit XX. - kërkuan një investim të madh të kohës dhe parave. Dhe në një qelizë të gjallë, sinteza e proteinave vjen me një lehtësi mahnitëse: montimi i një molekule hemoglobine, e përbërë nga 574 mbetje aminoacide, përfundon në 90 sekonda. Zhvillimi dhe prezantimi në prodhimin e metodave biologjike për prodhimin e produkteve dhe proteinave që përmbajnë proteina është gjithashtu pjesë e programit "bionics kimikë". Në Kirishi (Oblasti i Leningradit) në fund të vitit 1974, uzina e Biokhim-it u vu në punë dhe prodhoi produktet e para, ku maja e foragjereve rritet në një mjedis të tillë aspak tërheqës, si produktet e naftës. Në planin afatgjatë, është planifikuar zhvillimi i sintezës së proteinave bazuar në arritjet e "inxhinierisë gjenetike". Proteinat do të prodhohen në bimë gjenetike, në disa punëtori nga të cilat gjenet do të ndërtohen, në të tjera proteinat e nevojshme do të sintetizohen.
Shembuj që tregojnë zgjerimin e madh dhe në rritje të fushës së aplikimit të biologjisë molekulare mund të vazhdojnë, por gjithashtu është e qartë se revolucioni në biologji e ka shndërruar atë në një forcë prodhuese të fuqishme dhe premtuese, të aftë për të vendosur dhe zgjidhur detyra që deri vonë dukeshin absolutisht fantastike. Në këtë drejtim, për shembull, këndvështrimi i Akademikut V. A. Engelhardt në lidhje me mundësinë e krijimit të një edukimi të gjallë artificial, domethënë sintetizimin e jetës: "Pa e lejuar veten të largohet nga deklarata tepër të nxituara ... është e mundur me plot të themi me siguri se qëllimi, i cili kohët e fundit dukej i paarritshëm - krijimi artificial i formave më të thjeshta të të jetuarit - është mjaft i arritshëm ”.
referencat:
1. Green N, Stout, W. Taylor D. Biologjia në 3 vëllime T. Vol. 1: Trans. nga anglishtja / Ed. R. Sopera. M .: Mir, 1990.368 s., Ill.
2. Brown A. D. dhe Fadeev M. D. Themelat molekulare të jetës. Një manual për mësuesit. M., Iluminizmi, 1976.
3. Shulpin G. B. Kjo kimi magjepsëse. M .: Kimi, 1984.
4. L. Pauling, P. Pauling. Kimi. Ed. Bota. Moska. 1978.
5. Nechaev A. P. Kimi organike: libër shkollor. për studentët e shkollave ushqimore. M .: më i lartë. Pretendim., 1988.319 s., I sëmurë.
6. Palov I. Yu., Vakhnenko D. V., Moskvichev D. V. Biologjia. Manuali është një mësues për aplikantët në universitete. Rostov-on-Don. Ed. Phoenix. 1999.576 fq.
7. Biologji për aplikantët në universitete. Ed. V.N. Yarygin. M .: më i lartë. shkollë., 1995.487 s., i sëmurë.
Plus abstrakt
MINISTRIA E ARSIMIT T F Federatës Ruse
UNIVERSITETI SHTETROR ALTAI
Fakulteti i Kimisë
Puna e kursit
tema: Struktura e polimereve, biopolimerëve
Struktura e proteinave
Puna e përfunduar:
student 4 vjeçar
kontrolloni:
ph.D., Profesor i Asociuar
"___" _____________ 2002
Vlerësimi _______________
_______________________
(nënshkrimi i kokës)
Barnaul 2002
1. Whatfarë është një polimer ?. 4
1.1. Karakteristikat e strukturës së polimereve. 4
2. Polimere natyrale .. 6
2.1. Fiber. 6
2.2. Gomës. 7
2.3. Polimere biologjike .. 7
3. Polimere sintetike .. 8
3.1. Fiber. 8
3.2. Kauçuku. 9
3.3. Polimere kristalore .. 10
3.4. Xham dhe rrëshirë .. 10
4. Peshat mesatare molekulare .. 11
5. Konfigurimi, stereokimi dhe konformimi i zinxhirit. 12
6. Klasifikimi i polimereve. 15
7. Tranzicionet termike në polimere. 18
8. Ketrat. 20
9. Lidhjet kimike në një molekulë proteine. 21
10. Nivelet e organizimit strukturor të një molekule proteine. 23
10.1. Struktura parësore. 23
10.2. Struktura sekondare. 25
10.2.1. a-spiral. 25
10.2.3. Spirale kolagjenike. 27
10.2.4. Strukturat nën-sekondare dhe fushat strukturore .. 27
10.3. Struktura terciare. 27
10.4. Struktura kuaternare. 29
Letërsi. 31
1. Whatfarë është një polimer?
1.1. Karakteristikat e strukturës së polimereve
Fjala polimer fjalë për fjalë do të thotë - shumë segmente (nga greqishtja polusShumë dhe tEROSPjesë, segmente).
Ky term përfshin të gjitha substancat, molekulat e të cilave janë ndërtuar nga shumë elementë, ose njësi. Këta elementë përfshijnë të dy atomet individualë dhe (më shpesh) grupet e vogla të atomeve të lidhura me lidhje kimike. Një shembull i një polimeri me elemente që përbëhen nga atome elementare është i ashtuquajturi "squfur plastik". Përftohet duke derdhur një shkrirë squfuri (në temperaturën e duhur) në ujë të ftohtë. Struktura e squfurit të polimerit mund të përfaqësohet si një zinxhir atomesh të lidhura me njëri-tjetrin nga lidhje kimike
Në këtë gjendje, vetitë fizike të squfurit janë të ndryshme nga ato të squfurit të zakonshëm kristalor ose të shkëmbit - ato janë më tipike për polimeret gome. E butë, shumë elastike dhe e tejdukshme, nuk ka, në kontrast me substancat kristalore, një pikë specifike shkrirjeje. Kur temperatura rritet, squfuri së pari zbutet, dhe më pas rrjedh si një lëng shumë viskoz. Sidoqoftë, squfuri i polimerit nuk është i qëndrueshëm, dhe në temperaturën e dhomës pas disa ditësh kthehet në formën e tij të zakonshme pluhur ose kristaline.
Për shumicën e polimereve, elementi strukturor që përsëritet është grupe të vogla të atomeve të lidhura në një mënyrë të caktuar. Një nga më të thjeshtë nga këndvështrimi i strukturës kimike të polimereve - polietileni ka një grup CH2 si një element përsëritës.
Molekula origjinale nga e cila formohet polimeri quhet njësia monomer (nga greqishtja monos - beqare). Siç tregon ky shembull, njësia monomer nuk është gjithmonë një element përsëritës i zinxhirit.
Sidoqoftë, lidhjet zinxhirore nuk janë gjithmonë identike. Shumë polimere formohen nga bashkëveprimi i dy llojeve të ndryshme të njësive monomer ose përbërjeve kimike. Kjo çon në një strukturë tipi
http://pandia.ru/text/78/042/images/image002_56.gif "width \u003d" 333 "height \u003d" 19 src \u003d "\u003e
Një ndërtim i tillë është karakteristik për shumë gome sintetike.
Një prej lidhjeve, të themi B, mund të lidhet me A jo vetëm në skajet, por edhe në pikën e tretë. Kjo lejon që zinxhirët të degëzohen:
Një polimer i tillë mund të "rritet" nga secila pikë e degës, duke formuar një strukturë komplekse tre-dimensionale shumë të degëzuar.
Deri më tani, ne nuk i kemi kushtuar vëmendje çështjes në lidhje me numrin njësi elementare në një molekulë, të domosdoshme që një substancë të klasifikohet si polimer. Cili është ky numër që përbën konceptin e shumë?
Nuk ka përgjigje të saktë për këtë pyetje. Në përgjithësi, çdo numër nga dy ose më shumë korrespondon me një polimer. Sidoqoftë, polimeret që përmbajnë disa njësi zakonisht quhen dimers, zbukurues, tetramers, etj., Nga numri i molekulave fillestare të përfshira në to, ose njësive monomerike, dhe termi polimer (më saktë, polimer i lartë ) i referohet rastit kur numri i lidhjeve në zinxhir është mjaft i madh. Numri minimal i njësive monomer të polimerit të lartë është rreth 100. Numri maksimal i njësive është teorikisht i pakufizuar
2. Polimere natyrale
2.1. fibrave
Midis polimereve natyrore me rëndësi industriale, fibrat me origjinë bimore dhe shtazore zënë vendin më të rëndësishëm.
Pronë kryesore e fibrës është forca e lartë e saj elastike. Kjo veti specifike është për shkak të një rregullimi specifik të molekulave në strukturën e fibrës. Fijet zakonisht përmbajnë kristale dhe kristalitete shumë të vegjël dhe kristalitët janë të zgjatur, ose “të orientuar” përgjatë fibrës, në mënyrë që molekulat e zinxhirit të gjatë të jenë paralel ose pothuajse paralel me boshtin e fibrës. Ky rregullim gjeometrik i zinxhirëve kundërshton në mënyrë më efektive deformimin ose shkatërrimin e strukturës nën ndikimin e forcave tërheqëse.
Merrni tekstin e plotëQë nga kohërat e lashta, fibrat natyrale janë përdorur gjerësisht, bazuar në një substancë kimike - celulozë. Ajo ka një strukturë mjaft komplekse të zinxhirit, lidhja përsëritëse e së cilës është përbërja C6H10O5.
Nga fijet e tjera natyrore me rëndësi industriale, duhet përmendur leshi dhe mëndafshi. Këto janë produkte shtazore. Gjëndrat e krimbit të mëndafshtit sekretojnë fijet e mëndafshta nga të cilat formohet një zorrë e trashë. Nga pikëpamja kimike, leshi dhe mëndafshi janë proteina, një klasë shumë e gjerë e substancave që është e përhapur në botën e bimëve dhe kafshëve.
Proteinat ndryshojnë nga polimeret tashmë të konsideruara në atë që zinxhiri i tyre është i ndërtuar nga elementë përsëritës të një strukture kimike të pabarabartë. Formula e përgjithshme e lidhjes elementare të zinxhirit të proteinave
Thirrni kolagjenin "href \u003d" / text / kategoria / koll / "rel \u003d" bookmark "\u003e proteinë kryesore e lëkurës.
Fortësia e lëkurës, e cila arrihet me trajtimin kimik (rrezitje) të lëkurave, është për shkak të rrjetit të fibrave të tyre të kolagjenit.
3. Polimere sintetike
3.1. fibrave
Ndër fijet, duhet të bëjmë dallimin midis atyre sintetike, d.m.th, atyre, molekulat e mëdha të të cilave janë ndërtuar ose sintetizuar nga komponimet kimike shumë të thjeshta, dhe ato të marra nga polimere natyrale (zakonisht celuloza) duke i përpunuar kimikisht ato në forma të tjera. Të dy këta lloj polimerësh përmenden kolektivisht si fijet kimike. Për të prodhuar një fibër filamentoze të vazhdueshme, polimeri fillestar duhet të jetë i lëngshëm - në formën e një shkrirje ose zgjidhjeje. Celuloza si një material i mundshëm për qëllime të tilla ka një pengesë të madhe - jo vetëm që nuk shkrihet, por nuk shpërndahet as në ujë ose në tretës organikë të zakonshëm. Prandaj, për të përdorur celulozën, ajo duhet të përpunohet. Një nga metodat e përpunimit është se acidi acetik vepron në celulozë, si rezultat i së cilës shndërrohet në acetate celuloze. Acetati i celulozës është shumë i tretshëm në tretës organikë, siç është acetoni; kjo formon një zgjidhje shumë viskoze të shurupit, e cila mund të shtypet përmes një teli shumë-kanalësh që përmban numrin e kërkuar të vrimave të bluarjes; si rezultat, merret një tufë fibrash të hollë, të cilat, pas vizatimit dhe avullimit të tretësit, formojnë një fije të vazhdueshme të acetatit të celulozës. Në një lloj procesi tjetër, masa e lëngshme e shtrydhur e celulozës së modifikuar kimikisht i nënshtrohet një trajtimi që e shndërron atë në celulozë origjinale. Ky produkt, i njohur si mëndafshi viskoz, është një shembull i fibrës celuloze të rigjeneruar.
Të gjitha fibrat nga polimeret sintetike prodhohen në formën e filamenteve të vazhdueshëm. Për dallim nga celulozi, këto polimere mund të shkrihen lehtësisht.
Fijet sintetike nuk duhet të konsiderohen si zëvendësues të fibrave natyrore ose si fibra "artificiale"; ato kanë veti të ndryshme dhe në disa aspekte janë superiore ndaj fibrave natyrale. Ekzistojnë shumë lloje të fibrave sintetike: najlone, polesters (terylene, lavsan), fibra akrilike (orlon), dhe fibra polipropileni (alstron).
3.2. artikuj prej kauçuku
Goma sintetike më e rëndësishme para Luftës së Dytë Botërore ishte goma Buna: butadiene është një lidhje e përsëritur në zinxhir.
Kërkimet për bimë të ndryshme gome u kryen në Afrikë, dhe megjithëse u gjetën një numër bimësh, kontributi i tyre i mundshëm ishte i parëndësishëm. Situata u lehtësua me ardhjen e gomës sintetike amerikane, e njohur si GR-S.
Ka një strukturë më komplekse sesa goma e Bunës gjermane, është një kopolimer i përbërë nga dy përbërës - butadiene dhe stirenë. Kjo gome doli të ishte më e keqe se e natyrshme në një numër pronash, “ngjitja” e pamjaftueshme e saj ose ngjitja krijuan vështirësi, për shembull, në prodhimin e gomave të makinave, por ky problem u zgjidh pas zhvillimit të teknologjive për përzierjen e tij me sasi të vogla të gomës natyrale.
Merrni tekstin e plotëNjë tjetër gome sintetike e rëndësishme është goma butil, një polimer që rrjedh nga izobutileni. Sidoqoftë, veçantia e gomës butilike është se ajri shpërndahet përmes tij shumë më ngadalë sesa përmes gomës natyrale, prandaj, goma butil është e vlefshme si bazë për prodhimin e kamerave të automobilave. Sidoqoftë, në krahasim me gomën natyrale, vetitë e saj elastike janë shumë më të këqija.
Në dallim nga fibrat, gomat e rrobave në përgjithësi nuk janë kristalore; molekulat e tyre janë të çrregulluara. Struktura e gomave, në shumë mënyra të ngjashme me strukturën e një lëngu, quhet amorfe. Shtë kjo strukturë e lirshme (në kontrast me strukturën e dendur të kristalit të rregullt) që gomat i detyrohen butësisë dhe fleksibilitetit të tyre.
3.3. Polimere kristalore
E treta dhe në shumë aspekte klasa më interesante e polimereve sintetike është polimere kristalore. Për dallim nga materialet e ngurta kristalore, polimeret nuk janë plotësisht kristalore, por përmbajnë shumë kristale shumë të vogla që ekzistojnë së bashku me pjesën tjetër të një lënde të çrregulluar ose amorfe. Në gjendje të paorientuar, ato nuk kanë natyrë analoge, dhe vetitë e tyre ndryshojnë nga vetitë e substancave që janë njohur deri më tani.
Një prej polimereve kristalore më të përdorura dhe të përdorur gjerësisht është polietileni. Ka veti të shkëlqyera izoluese, si dhe butësi dhe elasticitet. Polietileni ka një pengesë - OH shkrihet në një temperaturë relativisht të ulët (110 ° C-130 ° C)
Një tjetër polimer i rëndësishëm kristalor është najlon, i cili ka veti të shkëlqyera për formimin e fibrave, por mund të merret edhe në formën e blloqeve për prodhimin e produkteve të formuara me injeksion. Mp. (najlon) - 265 ° C.
Struktura e zinxhirit polimer, hetero ka hidrogjen bor
/text/categ/nauka.php "class \u003d" myButtonNauka "\u003e Merrni tekstin e plotë
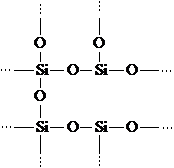
Polimerët e organoelementit përmbajnë si grupe organike ashtu edhe ato inorganike. Një shembull i një polimeri organoelement zinxhir hetero është polidimetilsiloksani [-Si (CH3) 2O-] n. Ose, për shembull, polyorganophosphazenes [-PR2 \u003d N-] n.
Polimere makromolekulat e të cilave përbëhen nga njësi të përsëritura të të njëjtit lloj quhen homopolymers . kopolimere makromolekulat përmbajnë njësi monomerike të disa llojeve. Më poshtë është një klasifikim i kopolimerëve që përmbajnë njësi të përsëritura të dy llojeve, të përcaktuara në mënyrë konvencionale si A dhe B:
Nga pikëpamja e strukturës së zinxhirit kryesor, makromolekulat ndahen në lineare, me dy tela (dy zinxhirë paralelë, të lidhur në mënyra të ndryshme), të degëzuara dhe të ndërlidhura (rrjetë). Më poshtë është një klasifikim i makromolekulave sipas strukturës së zinxhirit kryesor:
Lloji i konfigurimit | Struktura e zinxhirit |
Makromolekulat lineare | |
Makromolekulat me dy fije shkallë spiro copolymers | |
Makromolekulat e degëzuara | |
statistikor | |
krehër | |
yll | |
Qepur (rrjetë) | |
ne aeroplan (parket) | |
në hapësirë |
7. Tranzicionet termike në polimere
Për polimeret, ekzistojnë dy lloje kryesore të temperaturave të tranzicionit: pika e shkrirjes (Mp.) Dhe temperatura e tranzicionit të qelqit (Tw.).
Pika e shkrirjes është pika e shkrirjes së fazës kristalore të polimerit.
Temperatura e tranzicionit të qelqit është temperatura në të cilën rajonet amorfe të polimerit fitojnë veti karakteristike të gjendjes së qelqit: brishtësia, ngurtësia dhe forca. Dallimet midis dy tranzicioneve të treguara termike mund të kuptohen lehtësisht duke marrë parasysh ndryshimet që ndodhin në një polimer të ndryshëm, të lëngshëm kur ftohet. Me uljen e temperaturës, energjia përkthimore, rrotulluese dhe vibruese në molekulën e polimerit zvogëlohet. Kur energjia totale e molekulës zvogëlohet në një vlerë në të cilën energjia përkthimore dhe rrotulluese mungojnë praktikisht, kristalizimi i polimerit bëhet i mundur. Për më tepër, nëse përmbushen kërkesa të caktuara të simetrisë, atëherë molekulat mund të marrin një rregullim të urdhëruar dhe kristalizimi realizohet kështu. Temperatura në të cilën ndodh ky proces është Mp .. Sidoqoftë, jo të gjitha polimerët krijojnë kushtet e nevojshme për kristalizim. Nëse kërkesat e simetrisë nuk janë të kënaqura, atëherë kristalizimi nuk ndodh, por ndërsa temperatura zvogëlohet më tej, energjia e molekulës vazhdon të ulet. Me arritjen Tw. lëvizja segmentale e zinxhirëve polimer pushon për shkak të dobësimit të fortë të rrotullimit të lidhjeve.
Mundësia e realizimit të njërit ose të dyve tranzicionet termike varet nga morfologjia e tij. Polimere plotësisht amorfe karakterizohen vetëm Tw., ndërsa polimeret plotësisht polimere kristalore kanë vetëm Mp .. Shumica e polimereve Mp. ato i nënshtrohen kristalizimit vetëm pjesërisht; polimere gjysëm kristaline të ngjashme karakterizohen nga një pikë e shkrirjes dhe një temperaturë e tranzicionit të qelqit. Tranzicionet termike maten lehtësisht nga ndryshimet në vetitë si vëllimi specifik, kapaciteti i nxehtësisë. Shifra tregon varësinë e temperaturës së vëllimit specifik për një polimer plotësisht amorf dhe plotësisht kristalor (linjat e ngurta). Pika e shkrirjes - ky është një tranzicion i rendit të parë me një ndryshim shumë të mprehtë në vëllimin specifik; temperatura e formimit të qelqit është një tranzicion i llojit të dytë i karakterizuar vetëm nga një ndryshim në koeficientin e temperaturës së vëllimit specifik. Lakorja përkatëse për një polimer gjysëm kristalor përbëhet nga një kurbë për një polimer kristalor dhe një vijë të thyer që korrespondon me rajonin e kalimit në gjendjen e qelqit.
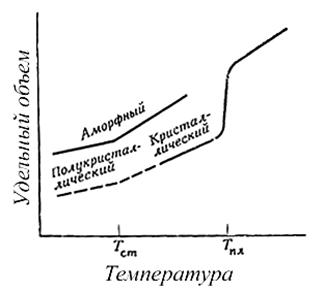
Fig. 2. Përcaktimi i temperaturës së kalimit të qelqit dhe temperaturës së shkrirjes së polimerit duke ndryshuar vëllimin e tij specifik.
Temperaturat e shkrirjes dhe kalimit të qelqit të polimerit ndikojnë në vetitë mekanike të polimerit në një temperaturë të caktuar dhe përcaktojnë diapazonin e temperaturës për përdorimin e tij. Të dy tranzicionet termike, si rregull, preken në mënyrë të barabartë nga simetria molekulare, ngurtësia strukturore dhe ndërveprimi ndërmolekular. Ndërveprimi i fortë ndërmolekular (për shkak të polaritetit të lartë ose lidhjeve të hidrogjenit) çon në forca të forta kristalizimi, gjë që çon në Tm të lartë. Ndërveprimi i fortë ndërmolekular gjithashtu ul lëvizshmërinë e zinxhirëve të polimerit amorf, duke rezultuar në Tw. kanë vlera të larta.
Sipas shumës tw. dhe mp. ndikohet fuqimisht edhe simetria molekulare e zinxhirëve polimer. Polimeret strukturore asimetrike (p.sh. klorur polivinil dhe polipropileni) kanë më të larta tw. dhe Mp., sesa analogët e tyre simetrikë (klorur poliviniliden dhe polisobutilen). Zinxhirët asimetrikë janë më polarë, dhe për këtë arsye mund të paketohen më të dendura, duke siguruar një ndërveprim më të fortë ndërmolekular.
8. Proteinat
Proteinat janë polimere, më saktë, kopolimerët që përbëhen nga mbetjet e aminoacideve që ndryshojnë në natyrën e R.
Merrni tekstin e plotëAta quhen biopolimerë:
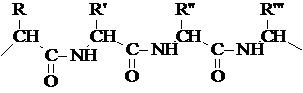
Përbërja e proteinave përfshin 20 nga aminoacidet më universale, të ashtuquajturat "magjike" dhe deri në një duzinë më të rrallë. Në makromolekulat e proteinave të ndryshme, këto aminoacide alternojnë në mënyra të ndryshme. Struktura kimike e disa substancave proteinike është deshifruar, megjithatë, formula e substancave të tilla si kazina, keratina, kolagjen, të përdorura në industri, janë të panjohura.
kazeinë - një proteinë komplekse e formuar nga kazinoogjeni (përbërësi më i rëndësishëm i qumështit, gjizës dhe djathit) kur mpikset nën ndikimin e enzimave. Përveç atomeve C, H, O dhe N, kazeina përmban R.
keratins - substanca proteinike, të cilat janë përbërësi kryesor i indeve që kryejnë funksione integruese dhe mbrojtëse në organizmat e kafshëve (lëkura, briri, flokët, flokët). Keratins karakterizohen nga një përmbajtje e lartë e squfurit.
kolagjeni - substanca proteinike, një pjesë integrale e indit lidhës; në veçanti, shumë kolagjen gjenden në kockat e kafshëve.
Përpunimi special i eshtrave, brirëve dhe lëkurës së kafshëve në industri prodhon xhelatinë - një përzierje e substancave proteinike me origjinë shtazore.
Proteinat janë ato mjete molekulare me të cilat realizohet informacioni gjenetik.
Shtë informacioni që përmbahet në sekuencën lineare të nukleotideve të ADN-së që përcakton sekuencën lineare të aminoacideve në zinxhirin polipeptid të proteinës së sintetizuar. Vetë zinxhiri polipeptid linear që rezulton në vetvete tani është i pajisur me informacione funksionale, sipas të cilit shndërrohet në mënyrë spontane në një strukturë të caktuar tre-dimensionale të qëndrueshme. Kështu, zinxhiri polipeptid i ndjeshëm është palosur, i shtrembëruar në strukturën hapësinore të molekulës së proteinave, dhe jo rastësisht, por në përputhje të rreptë me informacionin që përmbahet në sekuencën e aminoacideve.
9. Lidhjet kimike në një molekulë proteine
Në përgjithësi, një molekulë proteine \u200b\u200bkarakterizohet nga prania e lidhjeve të forta kovalente dhe relativisht të dobëta jo kovalente. Ky kombinim i lidhjeve siguron proteina me një forcë dhe dinamizëm të caktuar në procesin e funksionimit.
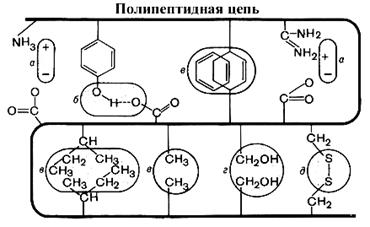
Fig. 3. Lidhjet kimike në një molekulë proteine.
Shifra tregon llojet e lidhjeve midis radikalëve të mbetjeve të aminoacideve në një molekulë proteine.
a) bashkëveprimi elektrostatik
b) lidhjet e hidrogjenit
c) bashkëveprimi i zinxhirëve anësorë jo polarë të shkaktuar nga dëbimi i radikalëve hidrofobikë në zonën e "thatë" nga molekulat tretës.
d) lidhjet disulfide (linja e dyfishtë e lakuar nënkupton kreshtën e lidhjes polipeptide)
Obligacione kovalentenë një molekulë proteine \u200b\u200bmund të jetë e dy llojeve - disulfide dhe peptid.
Peptidi ose acid-amidi (-CO-NH-) ndodh kur grupi karboksil i një amino acidi ndërvepron me grupin a-amino të një tjetri.
Duke përdorur analizën e difraksionit me rreze X, u zbulua se lidhja midis atomit të grupit karbonil dhe atomit të azotit të njësisë peptidike është pjesërisht lidhje e dyfishtë.
Gjatësia e lidhjes është 0,132 nm, që është vlera mesatare midis distancave që korrespondojnë me lidhje dyfishe dhe të vetme midis këtyre atomeve. Lidhja - CO - NH - ka një konfigurim trans, dhe atomet fqinj të karbonit janë në një marrëveshje trans. Pjesa trans-peptide është e ngurtë, dhe rotacioni i lirë është i mundur vetëm rreth lidhjeve CC dhe N-Ca. Rrotullimi rreth këtyre lidhjeve karakterizohet nga kënde të ndryshme.
Një rol të rëndësishëm në stabilizimin e strukturës hapësinore të molekulës së proteinave luhet nga lidhjet disulfide kovalente (S-S), të cilat formohen si rezultat i oksidimit të grupeve sulfhidryl të mbetjes së cistenës.
Lidhjet dhe bashkëveprimet jo kovalente luajnë një rol thelbësor në stabilizimin e konformitetit të një molekule proteine. Këto përfshijnë ndërveprime hidrofobike, lidhjet elektrostatike, jonike, si dhe lidhjet e hidrogjenit.
Ndërveprimi hidrofobik ndodh kur bashkohen hidrokarbure hidrofobe dhe radikale aromatike të aminoacideve të caktuara. Procesi i bashkëveprimit hidrofobik mund të paraqitet si lëvizja e grupeve jopolare të zinxhirit polipeptid nga uji në rajonet hidrofobike.
Lidhje hidrogjeni formohen midis atomeve të hidrogjenit të lidhura kovalente me një atom që përmban një çift elektroni të pa ndarë dhe një atom tjetër elektronegativ (N ose O). Në proteina dhe polipeptide, lidhjet e hidrogjenit mund të jenë brenda - dhe ndërlidhëse. Lidhjet hidrogjenore brenda zinxhirit stabilizojnë lidhjet a-spirale dhe ndër-rrjetore stabilizojnë strukturat me palosje b.
Lidhje jonike (kripe) formohen nga grupet e lira të disociuara të acidit karboksilik (COO-) të aminoacideve monoaminodikarboksilike dhe aminoacideve të lira të protonuara të (NH3 +) aminoacideve diaminomonokarboksilike. Obligacionet jonike mund të jenë brenda - dhe ndërlidhëse.
10. Nivelet e organizimit strukturor të një molekule proteine
Karakteristikat funksionale të proteinave përcaktohen nga sekuenca e aminoacideve dhe konfigurimit, d.m.th, organizimi strukturor i tyre ose struktura hapësinore. Nga ky këndvështrim, dallohen katër nivele: strukturat parësore, sekondare, terciare dhe kuaternare.
10.1. Struktura parësore
Kuptoni përbërjen cilësore dhe sasiore të aminoacideve, si dhe sekuencën e tyre në zinxhirët polipeptidikë të një molekule proteine. Struktura parësore bazohet në lidhjet peptide.
Merrni tekstin e plotëAnaliza e të dhënave mbi strukturën parësore na lejon të nxjerrim përfundimet e mëposhtme:
1. Stabiliteti i strukturës parësore sigurohet kryesisht nga lidhjet peptide glavalente; Një numër i vogël i obligacioneve disulfide është gjithashtu i mundur.
2. Në zinxhirin polipeptid mund të zbulohen kombinime të ndryshme të aminoacideve; sekuencat përsëritëse janë relativisht të rralla në polipeptide.
3. Secila proteinë individuale homogjene karakterizohet nga një strukturë unike parësore; shpeshtësia e zëvendësimit të aminoacideve çon jo vetëm në rirregullimet strukturore, por edhe në ndryshime në vetitë fiziko-kimike dhe funksionet biologjike.
4. Në disa enzima me veti të ngjashme, konstatohen struktura identike peptide, veçanërisht në rajonet e qendrave të tyre aktive.

Fig. 4. Struktura kryesore e RNase. (theksohen katër lidhje disulfide).
http://pandia.ru/text/78/042/images/image035_7.jpg "width \u003d" 324 "height \u003d" 344 src \u003d "\u003e
Fig. 6. a-helikulare a) zinxhir polipeptid i konfigurimit të a-peptidit; b) skeleti i një spiraleje.
10.2.2. struktura b-fish
Me këtë rregullim hapësinor të sekuencës së aminoacideve, formohet një sistem fragmentesh të vendosura paralele dhe antiparale të një ose më shumë zinxhirëve polipeptidikë. Zinxhirët polipeptidë në b-folds janë zgjatur plotësisht.
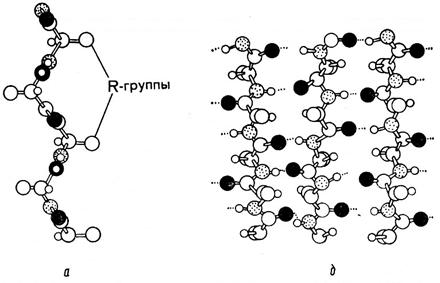
Fig. 7. struktura b-fish a) pamje anësore; b) pamje e sipërme.
Dosjet shfaqen për shkak të faktit se aeroplanët e dy lidhjeve peptide ngjitur formojnë një kënd të caktuar. Sistemi është i stabilizuar për shkak të lidhjeve tërthore të hidrogjenit midis zinxhirëve të vendosur pingul me orientimin e lidhjeve peptide
Distanca midis zinxhirëve është 0.95 nm, dhe periudha e identitetit përgjatë zinxhirit është 0.70 nm për zinxhirët paralelë, dhe 0.65 nm për ato antiparalele.
10.2.3. Spiral i kolagjenit
Përbëhet nga tre tropokollagë spirale që kanë një formë shufre me një diametër prej 1.5 nm dhe një gjatësi prej rreth 300 nm. Zinxhirët spiralë rrotullohen njëra rreth tjetrës dhe formojnë një mbinjeri. Distanca midis dy mbetjeve të aminoacideve përgjatë boshtit të heliksit është 0.29 nm. Helika e kolagjenit është e stabilizuar nga lidhjet e hidrogjenit që lindin midis hidrogjenit të grupeve peptide NH të mbetjeve aminoacide të një zinxhiri dhe oksigjenit të CO - grupeve të mbetjeve aminoacide të tjetrës. Kjo strukturë jep elasticitet dhe forcë të kolagjenit.
10.2.4. Strukturat nën-sekondare dhe fushat strukturore
Metodat e analizës së difraksionit me rreze X kanë vërtetuar tani ekzistencën e dy niveleve të organizimit strukturor të molekulës proteinike, e cila doli të jetë e ndërmjetme midis strukturave sekondare dhe terciare. Këto janë të ashtuquajturat struktura nën sekondare dhe fusha strukturore. Të parat janë agregate të zinxhirëve polipeptidë që kanë strukturën e tyre sekondare dhe formohen në disa proteina si rezultat i qëndrueshmërisë së tyre termodinamike ose kinetike.
10.3. Struktura terciare
Me strukturë terciare nënkuptohet orientimi hapësinor i heliksit polipeptid ose metoda e palosjes së zinxhirit polipeptid në një vëllim të caktuar.
Proteina e parë, struktura terciare e së cilës u përcaktua nga J. Kendrew në bazë të analizës së difraksionit me rreze X, ishte mioglobina e balenës së spermës.
http://pandia.ru/text/78/042/images/image038_4.jpg "width \u003d" 389 "height \u003d" 239 "\u003e
Fig. 9. Llojet e obligacioneve jo kovalente që stabilizojnë strukturën terciare.
a) bashkëveprimi elektrostatik; b) lidhja e hidrogjenit; c) bashkëveprimet hidrofobike të grupeve jopolare; d) bashkëveprimi dipol - dipol; e) lidhje disulfide (kovalente)
Struktura terciare e proteinës, pas përfundimit të sintezës së saj në ribozomet, formohet automatikisht dhe përcaktohet plotësisht nga struktura parësore.
Kështu, struktura lineare një-dimensionale e zinxhirit polipeptid është e pajisur me informacione të një lloji tjetër - konformues, i cili përcakton formimin e një molekule proteinike të një forme të përcaktuar në mënyrë rigoroze me një rregullim hapësinor të caktuar. Nga ana tjetër, struktura tre-dimensionale e molekulës së proteinave gjithashtu përmban informacion, por të një lloji krejtësisht të ndryshëm, domethënë funksional, i cili quhet edhe informacion intramolekular.
10.4. Struktura kuaternare
Me këtë koncept nënkuptohet një mënyrë karakteristike e kombinimit dhe rregullimit në hapësirë \u200b\u200btë zinxhirëve polipeptidë individualë që përbëjnë një molekulë funksionale individuale.
Lidhjet hidrogjenore, elektrostatike, Van der Waals dhe ndërveprimet hidrofobike marrin pjesë në formimin e strukturës Kuaternare.
Struktura kuaternare e disa proteinave karakterizohet nga një rregullim globular i nënndarjeve (hemoglobina), proteina të tjera kombinohen në struktura quaternare spirale nga lloji i mozaikut helik (virusi i mozaikut të duhanit)
përfundim
Kështu, ekzistojnë katër nivele të strukturës së një molekule proteine. Të gjitha nivelet e strukturës janë të ndërlidhura, dhe radha e mbetjeve të aminoacideve, ose struktura parësore, përcakton plotësisht konformitetin e molekulës së proteinave. Manifestimi i aktivitetit biologjik varet nga nivelet më të larta të organizimit të tyre strukturor.
letërsi
1. et al. Hyrje në Polimer Kimi: Një Udhëzues Studimi për Ped. Universitete / et al. M., Më i Lartë. shkollë, 1988
2. J. Oudian. Bazat e kimisë polimer. Trans. nga anglishtja . Ed. Corr. Akademia e Shkencave e BRSS V. Në Cormac. Ed. Mir, Moskë, 1974
3. A. Trilor. Hyrje në shkencën e polimereve. Trans. nga anglishtja Ed. Mir, Moskë, 1973
4. Perepechenko në fizikën e polimere.-M.., "Kimi", 1978
5. Struktura Cormac dhe karakteristikat e temperaturës së polimereve. Shkencë, 1970
6. Polimer Tager
7. Përbërjet me molekulë të lartë: Libër mësuesi për teknologji të lartë.edicioni i tretë, më i lartë. Shkolla, 1981. -656p.
8. Kucherenko: teksti shkollor / N. E Kucherenko et al. - K: Vysha shk., Shtëpia Botuese në Universitetin e Kievit, 1988
9., Kimi Korovin: teksti shkollor, ed. .- M .: Mjekësia, 1983
Proteinat janë polimere natyrale që përbëhen nga mbetjet alfa-aminoacide të lidhura së bashku nga lidhjet peptide. Proteinat janë pjesë e qelizave dhe indeve të të gjithë organizmave të gjallë. Ata marrin pjesë në proceset më të rëndësishme të një organizmi të gjallë - metabolizmin, riprodhimin, rritjen, punën e muskujve, etj. Ata janë përbërësi kryesor i ushqimit tonë.
Historia e studimit Proteinat u izoluan në një klasë të veçantë të molekulave biologjike në shekullin XVIII, si rezultat i punës së kimistit francez Antoine Fourcroix. Kimisti Hollandez Gerrit Mulder kreu një analizë të përbërjes së proteinave dhe hipotezoi se pothuajse të gjitha proteinat kanë një formulë të ngjashme empirike. Termi "proteinë" për t'iu referuar molekulave të tilla u propozua në vitin 1838 nga kimisti suedez Jacob Berzelius. Mulder përcaktoi gjithashtu produktet e shkatërrimit të proteinave aminoacide dhe për njërën prej tyre (leucinë) me një shkallë të vogël gabimi përcaktoi peshën molekulare të 131 daltonëve. Në 1836, Mulder propozoi modelin e parë të strukturës kimike të proteinave. Bazuar në teorinë e radikalëve, ai formuloi konceptin e njësisë minimale strukturore të përbërjes së proteinave, C16H24N4O5, e cila u quajt "proteinë", dhe teorinë e "teorisë së proteinave" kimisti Hollandez Gerrit Mulder analizoi përbërjen e proteinave dhe hipotezoi që pothuajse të gjitha proteinat kanë një formulë të ngjashme empirike . Termi "proteinë" për t'iu referuar molekulave të tilla u propozua në vitin 1838 nga kimisti suedez Jacob Berzelius. Mulder përcaktoi gjithashtu produktet e shkatërrimit të proteinave aminoacide dhe për njërën prej tyre (leucinë) me një shkallë të vogël gabimi përcaktoi peshën molekulare të 131 daltonëve. Në 1836, Mulder propozoi modelin e parë të strukturës kimike të proteinave. Bazuar në teorinë e radikalëve, ai formuloi konceptin e një njësie minimale strukturore të përbërjes së proteinave, C16H24N4O5, e cila u quajt "proteina", dhe teoria e "teorisë së proteinave"

Struktura e proteinave kimisti gjerman Emil Fischer, sugjeroi që proteinat janë polimere të aminoacideve të lidhura nga një lidhje peptide. Ideja e natyrës polimer të strukturës së proteinave ishte shprehur tashmë nga Danilevsky dhe Hert, por ata besonin se "monomerët" janë formacione shumë komplekse - peptone ose "komplekse të azotit të karbonit". Vërtetimi i llojit peptid të përbërjes së mbetjeve të aminoacideve. E. Fisher vazhdoi nga vëzhgimet e mëposhtme. Së pari, gjatë hidrolizës së proteinave, dhe gjatë dekompozimit të tyre enzimatik, u formuan aminoacide të ndryshme. Përbërjet e tjera ishin jashtëzakonisht të vështira për t'u përshkruar dhe madje më të vështira për t'u marrë. Për më tepër, Fisher e dinte se as acidet as vetitë themelore nuk u vëzhguan në proteina, që do të thotë se, ai arsyetoi, grupet amino dhe karboksil në aminoacidet në molekulat e proteinave mbyllen dhe maskojnë njëra-tjetrën. Zbatimi i suksesshëm i punës e çoi Fisherin drejt suksesit. Duke punuar në të, ai tashmë është paralel në vite. Për herë të parë ai vërtetoi se vetëm L-stereoizomeret e aminoacideve janë pjesë e proteinave. lidhje peptide
![]()

Strukturat e proteinave Struktura primare Struktura parësore është sekuenca e aminoacideve në zinxhirin polipeptid. Karakteristikat e rëndësishme të strukturës parësore janë motive konservative për kombinimin e aminoacideve, të cilat luajnë një rol kryesor në funksionet e proteinave. Motivet konservatore ruhen gjatë evolucionit të specieve; shpesh është e mundur të parashikohet funksioni i një proteine \u200b\u200btë panjohur prej tyre. motive konservative të evolucionit Struktura parësore e motiveve konservatore të evolucionit
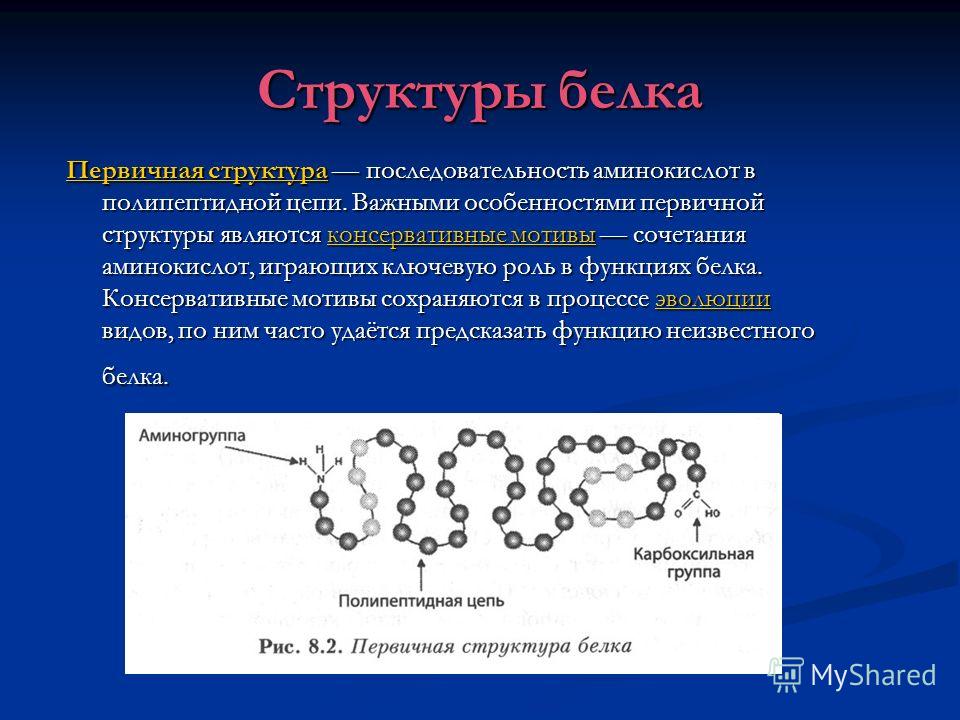
Struktura sekondare Renditja lokale e një fragmenti të një zinxhiri polipeptid, të stabilizuar nga lidhjet e hidrogjenit. lidhjet e hidrogjenit lidhjet e hidrogjenit Llojet e strukturës sekondare të proteinave: - α-helika; α-spiralet - β-çarçafët (shtresat e palosura); shtresat β-fletësh të palosura - π-spirale; - 3-spirale; fragmente të parregullta. Struktura sekondare e proteinave

Struktura terciare është struktura hapësinore e zinxhirit polipeptid (një grup koordinatave hapësinore të atomeve përbërëse të proteinës). Strukturisht, përbëhet nga elementë të një strukture sekondare të stabilizuar nga lloje të ndryshme ndërveprimesh në të cilat ndërveprimet hidrofobike luajnë një rol vendimtar. Stabilizimi i strukturës terciare përfshin: lidhje kovalente (midis dy mbetjeve të cistenit ura disulfide); lidhje kovalente (midis dy urave disistolide të mbetjeve të cisteinës); lidhjet jonike midis grupeve anësore të ngarkuara me kundërshtim të mbetjeve të aminoacideve; lidhjet jonike midis grupeve anësore të ngarkuara me kundërshtim të mbetjeve të aminoacideve; lidhjet e hidrogjenit; lidhjet e hidrogjenit; bashkëveprimet hidrofile-hidrofobike. bashkëveprimet hidrofile-hidrofobike.

Struktura kuaternare (ose nënnjësia, domeni) është rregullimi i ndërsjellë i disa zinxhirëve polipeptidë në një kompleks të vetëm proteinik. Molekulat e proteinave që përbëjnë proteinën me një strukturë kuaternare formohen veçmas në ribozomet dhe vetëm pas përfundimit të sintezës ato formojnë një strukturë të përbashkët supramolekulare. Një proteinë kuaternare mund të përmbajë si zinxhirë polipeptidikë identikë dhe të ndryshëm. Stabilizimi i strukturës Kuaternare përfshin të njëjtat lloje ndërveprimesh si në stabilizimin e Terciar. Komplekset proteinike supramolekulare mund të përbëhen nga dhjetëra molekula.


Proteinat fibrilare janë proteina që kanë një strukturë të filamentuar të zgjatur në të cilën raporti i boshtit tërthor me atë gjatësor është më i madh se 1:10. Shumica e proteinave fibrilare janë të tretshme në ujë, kanë një peshë të madhe molekulare dhe një strukturë hapësinore shumë të rregullt, e cila stabilizohet kryesisht nga ndërveprimet (përfshirë ato kovalente) midis zinxhirëve të ndryshëm polipeptidë. Struktura parësore dhe sekondare e proteinës fibrilare është, si rregull, e rregullt. proteina që kanë një strukturë filamentare të zgjatur, në të cilën raporti i boshtit tërthor me gjatësinë është më i madh se 1:10. Shumica e proteinave fibrilare janë të tretshme në ujë, kanë një peshë të madhe molekulare dhe një strukturë hapësinore shumë të rregullt, e cila stabilizohet kryesisht nga ndërveprimet (përfshirë ato kovalente) midis zinxhirëve të ndryshëm polipeptidë. Struktura parësore dhe sekondare e proteinës fibrilare është, si rregull, e rregullt.

Proteinat globulare janë proteina në molekulat e të cilave zinxhirët polipeptid janë palosur fort në strukturat sferike kompakte të globulës (struktura terciare e proteinës). proteina, në molekulat e të cilave zinxhirët polipeptid janë palosur fort në strukturat sferike globulare kompakte (strukturat e proteinave terciare). Proteinat globulare përfshijnë enzima, imunoglobulinat, disa hormone me natyrë proteine \u200b\u200b(për shembull, insulinë), si dhe proteina të tjera që kryejnë funksione transporti, rregullues dhe ndihmës.

Karakteristikat kimike Denaturimi - shkatërrim i pjesshëm ose i plotë i strukturës hapësinore, e natyrshme në një molekulë të caktuar proteinike. Mund të jetë i kthyeshëm ose i pakthyeshëm. Denaturimi ndodh nën ndikimin e: Denaturimit - shkatërrim i pjesshëm ose i plotë i strukturës hapësinore, e natyrshme në një molekulë të caktuar proteinike. Mund të jetë i kthyeshëm ose i pakthyeshëm. Denaturimi ndodh nën ndikimin e: - temperaturës së lartë - temperaturës së lartë - zgjidhjeve të acideve, alkalave dhe solucioneve të përqendruara të kripërave - zgjidhje të acideve, alkalave dhe solucioneve të përqendruara të kripërave - zgjidhje të kripërave të metaleve të rënda - zgjidhje të kripërave të metaleve të rënda - disa substanca organike (formaldehide, fenol) - disa lëndë organike (formaldehid, fenol) - rrezatim - rrezatim

Reagimet e ngjyrave Reagimi biuret - kur nxehet ure, formohet një biuret, i cili me një zgjidhje të sulfatit të bakrit në prani të alkali jep një ngjyrë vjollce. Substancat e grupit amide japin një reaksion biuret, dhe ky grup është i pranishëm në molekulën e proteinave.



Funksionet e proteinave funksion strukturor; Funksioni strukturor; Funksioni mbrojtës; Funksioni mbrojtës; Funksioni rregullator; Funksioni rregullator; Funksioni i sinjalit; Funksioni i sinjalit; Funksioni i transportit; Funksioni i transportit; Funksioni i rezervës (rezervë); Funksioni i rezervës (rezervë); Funksioni i receptorit; Funksioni i receptorit; Funksioni motorik (motorik). Funksioni motorik (motorik).




